琥珀酰辅酶A:代谢-表观遗传交叉调控的关键分子
琥珀酰辅酶A(Succinyl-CoA)不仅是三羧酸循环(TCA cycle)的关键中间体,近年更被揭示为一类重要的代谢物信号分子,通过驱动组蛋白赖氨酸琥珀酰化修饰,直接将细胞代谢状态与表观遗传调控相耦联。本文旨在结合该领域综述及核心研究,梳理琥珀酰辅酶A在这一交叉前沿中的调控作用与机制。
1. 代谢来源与信号整合
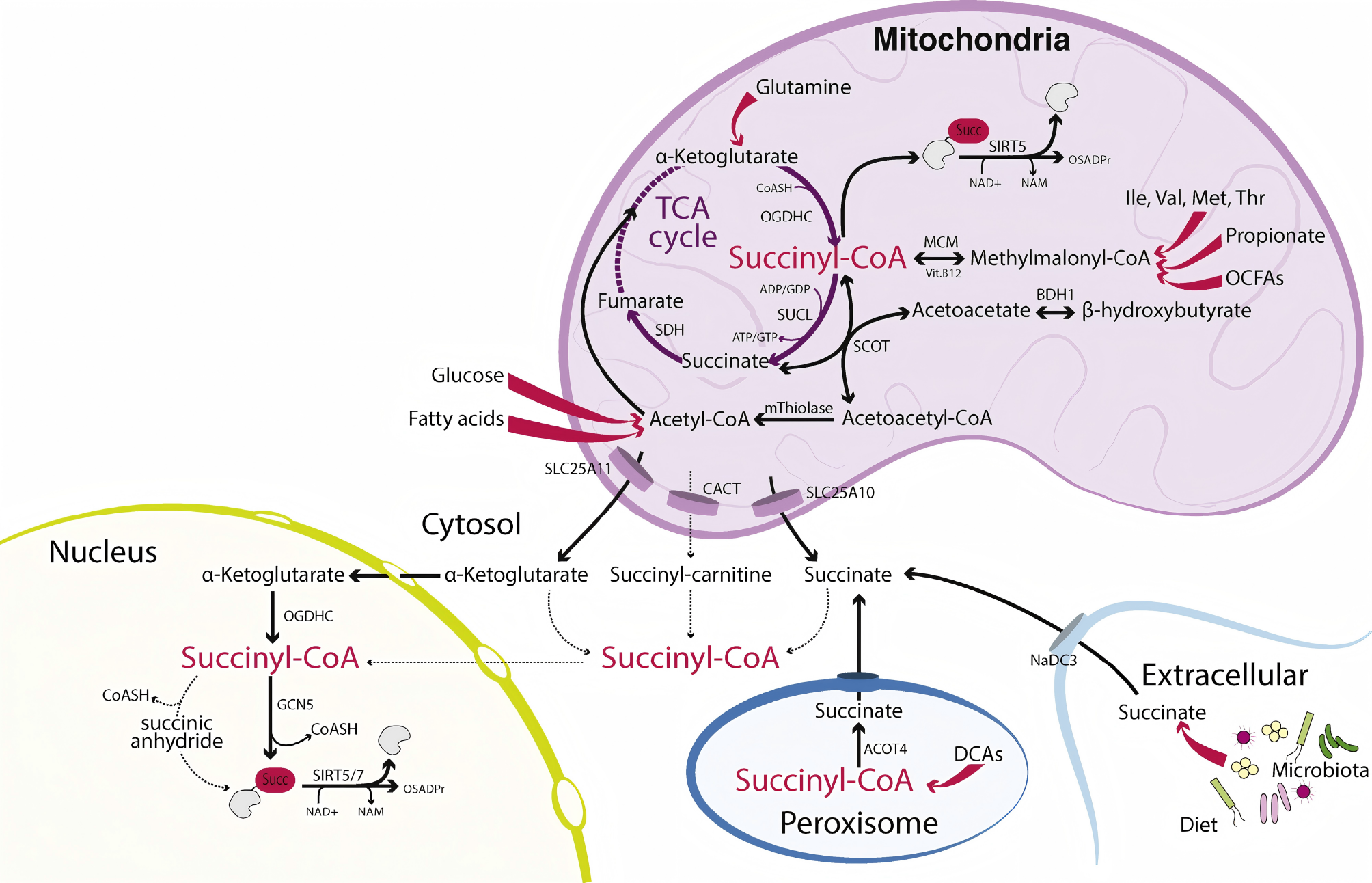
琥珀酰辅酶A的细胞内浓度受多种代谢通路动态调节,其水平变化是细胞能量、碳源与氮源代谢状态的综合反映:
线粒体内源性合成:
TCA循环:α-酮戊二酸经α-酮戊二酸脱氢酶复合物(OGDH)脱羧生成,其通量直接受葡萄糖、脂肪酸氧化速率调节。
氨基酸分解:支链氨基酸(异亮氨酸、缬氨酸)及甲硫氨酸、苏氨酸分解代谢生成丙酰辅酶A,经丙酰辅酶A羧化酶(PCC)与甲基丙二酰辅酶A变位酶(MCM)途径转化为琥珀酰辅酶A。
奇数链脂肪酸β-氧化:最终产物为丙酰辅酶A,进而进入琥珀酰辅酶A合成途径。
外源性/跨界来源:
肠道菌群代谢物:微生物发酵膳食纤维产生琥珀酸,可经宿主细胞摄取后由酰基辅酶A合成酶(如ACSS2)转化为琥珀酰辅酶A。
循环琥珀酸:在SDH缺陷或特定病理状态下,血浆琥珀酸水平升高,可被细胞通过NaDC-3等转运体摄入。
这些多元输入使琥珀酰辅酶A成为整合能量代谢、氨基酸代谢与微生物组信号的枢纽分子,其核内积累可能传递特定的营养与代谢状态信息。
2. 核内递送与区室化代谢机制
由于酰基辅酶A不能直接跨线粒体内膜转运,其核内可利用性高度依赖于前体分子的转运与局部合成机制,这体现了代谢的严格区室化特性。目前其核内来源尚未完全阐明,主要假说与证据包括:
琥珀酸穿梭途径:
线粒体琥珀酸可通过二羧酸转运体(SLC25A10)输出至胞质。胞质琥珀酸可能在未知的酰基辅酶A合成酶催化下重新酰化为琥珀酰辅酶A,该步骤是当前研究的空白之一。
α-酮戊二酸-OGDH核内代谢轴(机制仍具争议):
OGDH复合物组分被发现存在核定位,可能在核内催化α-酮戊二酸生成琥珀酰辅酶A。
关键争议:该研究组进一步报道核OGDH与组蛋白乙酰转移酶GCN5(KAT2A)互作,催化组蛋白H3第79位赖氨酸(H3K79)发生琥珀酰化。然而,Simithy等人(2017)的体外生化实验显示,在测试的多种乙酰转移酶(包括GCN5)中,未检测到显著的琥珀酰化催化活性。这一矛盾可能源于实验体系(如底物状态、辅因子环境)或检测灵敏度的差异,凸显了体内验证的必要性。
肉碱穿梭系统:
琥珀酰肉碱在琥珀酰辅酶A连接酶(SUCL)缺陷患者血浆中显著升高,提示存在肉碱依赖的琥珀酰基团外排途径。
然而,琥珀酰辅酶A并非肉碱乙酰转移酶(CrAT)的已知优选底物,琥珀酰肉碱如何在核-质区室内重新转化为琥珀酰辅酶A的机制仍是未知数。
3. 组蛋白琥珀酰化修饰的建立与去除:酶促与非酶促机制的博弈
核内积累的琥珀酰辅酶A可作为酰基供体,驱动组蛋白赖氨酸发生琥珀酰化修饰。该过程的建立存在非酶促与酶促两种潜在途径,二者在生理条件下的相对贡献与功能分工是核心科学问题。
非酶促修饰(可能占主导地位):
碱性依赖的亲核攻击:线粒体基质因其质子泵活动维持相对碱性环境(pH ~8.0)。在此条件下,组蛋白赖氨酸的ε-氨基更易去质子化,亲核性增强,可直接攻击琥珀酰辅酶A的羰基碳,形成修饰。
高反应性琥珀酸酐中间体机制:琥珀酰辅酶A的硫酯键不稳定,可自发水解生成一个高反应活性的五元环酸酐——琥珀酸酐。该中间体具有更强的亲电性,能在更广泛的pH范围内修饰赖氨酸残基。类似机制也见于丙二酰辅酶A、戊二酰辅酶A等其他二羧酰基辅酶A。
酶促调控系统:
写入酶(Writer):GCN5(KAT2A)是当前少数被报道可能催化组蛋白琥珀酰化的酶。如前述,其活性存在争议,且即便存在,催化效率也远低于其本底的乙酰化活性。
擦除酶(Eraser):SIRT5 :是主要的去琥珀酰化酶,对带负电荷的二羧酸酰化修饰(琥珀酰化、丙二酰化、戊二酰化)具有特异性偏好。SIRT5全身性敲除小鼠模型中,多个组织的蛋白质琥珀酰化水平显著上升,证实了其在维持该修饰稳态中的核心作用。SIRT7 :作为一种核内去琥珀酰化酶,在DNA损伤应答中发挥功能。它被PARP1招募至双链断裂位点,通过去除H3K122的琥珀酰化,促进局部染色质压缩,从而辅助DNA修复。
读取器(Reader):识别模块的发现有限。GAS41蛋白的YEATS结构域被鉴定能以pH依赖的方式结合琥珀酰化组蛋白。与拥有庞大溴结构域(Bromodomain)家族的乙酰化修饰相比,琥珀酰化已知的特异性“读取器”甚少,这暗示其功能可能更依赖于修饰引起的直接物化效应,或存在大量未被发现的识别元件。
4. 功能输出与生理病理意义
琥珀酰化修饰通过在赖氨酸残基上引入一个带双负电荷的琥珀酰基,产生强烈的电荷反转(从+1到-1)和显著的空间位阻,从而从物理化学层面深刻影响染色质结构与功能:
对染色质结构的直接效应:负电荷的引入会削弱带正电的组蛋白与带负电的DNA骨架之间的静电吸引,可能 destabilize 核小体结构。同时,额外的负电荷也可能干扰染色质纤维压缩过程中依赖阳离子(如组蛋白尾间相互作用或与Mg²⁺的桥接)的高阶结构组装,从而倾向于维持一种更为开放的染色质构象,便于转录机器接近。
转录调控:H3K79琥珀酰化被报道富集于基因启动子区,并与转录激活状态正相关(Wang et al., 2017)。然而,这种关联在多大程度上是琥珀酰化独有的功能,还是与位点上其他修饰(如乙酰化)共同作用或竞争的结果,仍有待明确。
代谢适应:在饥饿、高脂饮食诱导的代谢压力或棕色脂肪组织产热激活等状态下,组织与细胞的全局蛋白质琥珀酰化修饰谱发生显著重编程。研究表明,这些变化被证明参与调控糖异生、脂肪酸氧化等关键代谢通路相关基因的表达,是细胞适应能量与营养供应变化的重要表观遗传机制之一。
疾病关联:
肿瘤:琥珀酸脱氢酶(SDH)的失活突变导致琥珀酸大量累积,驱动广泛的异常蛋白琥珀酰化。这些修饰变化与HIF-1α转录因子的稳定化、表观遗传重编程及细胞增殖密切相关,被认为是SDH缺陷型肿瘤发生发展的关键环节。
代谢性疾病:在2型糖尿病、肥胖的动物模型及患者组织中,肝脏、脂肪等代谢关键器官呈现出特征性的蛋白质琥珀酰化修饰谱改变。这些异常修饰可能通过影响胰岛素信号通路关键蛋白的活性或改变代谢基因的转录,参与胰岛素抵抗和全身代谢稳态失调。
神经退行性疾病:阿尔茨海默病、帕金森病等普遍存在线粒体功能障碍。伴随的代谢紊乱可能导致神经元内琥珀酰辅酶A代谢失衡与异常的蛋白质琥珀酰化,进而影响与突触可塑性、细胞自噬和存活相关的基因表达程序。
5. 未来研究方向与核心科学问题
核内琥珀酰辅酶A的来源与动态定量:如何精确示踪并量化核内琥珀酰辅酶A池,明确其来源于线粒体前体输出、胞质合成还是核内局部生成的比例?这需要发展亚细胞分辨率(特别是核分离纯化)的代谢组学、基于稳定同位素示踪的动态通量分析以及质谱成像等前沿技术。
酶促与非酶促修饰的生理权重评估:在不同细胞类型、发育阶段或代谢压力下,两种机制对特定组蛋白位点琥珀酰化水平的相对贡献各占多少?需结合细胞与动物模型的遗传学操纵(如条件性敲除OGDH、GCN5)与能够区分修饰途径的化学探针进行系统性解析。
琥珀酰化修饰的特异性功能解码:其与乙酰化、丙酰化等修饰在相同或相邻赖氨酸位点是否存在竞争、协同或拮抗关系?如何将其独特的化学特性转化为特异的生物学输出?需借助位点特异性修饰抗体、基于CRISPR-dCas9的表观遗传编辑器以及定量蛋白质组学方法进行功能筛选与验证。
转化医学潜力的探索:能否以琥珀酰辅酶A代谢的关键节点(如OGDH)、修饰酶(如SIRT5、GCN5)或特异性识别器为靶点,开发小分子调节剂?这些干预手段在代谢综合征、癌症或神经退行性疾病的临床前模型中是否显示出治疗潜力?这将是衔接基础发现与临床应用的桥梁。
6. 总结
琥珀酰辅酶A及其介导的琥珀酰化修饰,是代谢与表观遗传两大核心细胞过程深度整合的典范。它超越了其作为能量代谢中间体的经典角色,进化成为一类能够承载丰富代谢信息、并直接改写染色质景观的关键信号分子。尽管其在核内的来源、修饰建立的精确机制以及独立于其他酰化修饰的特异性功能等方面仍存在大量未解之谜,但对该通路的持续深入研究,无疑有望为我们理解细胞如何感知复杂营养环境并相应调整其基因表达蓝图这一基本生命规律提供全新视角,并为一系列以代谢-表观遗传失调为特征的重大疾病提供潜在的新颖治疗策略与靶标。




