乙酰辅酶A:癌症中代谢与表观遗传的核心交汇点
一、核心科学问题:代谢如何重编程基因表达?
癌症研究范式正经历从“基因中心论”到“代谢-表观遗传交互论”的深刻转变。我们面临的核心科学问题是:癌细胞的代谢重塑,如何在不改变DNA序列的前提下,系统性重编程其基因表达,从而驱动无限增殖、侵袭转移等恶性表型?
乙酰辅酶A正是解码这一问题的关键化学信使。它处于细胞代谢与表观遗传调控网络的战略交汇点,具备双重核心身份:
核心代谢物:作为糖、脂、氨基酸代谢的整合节点,既参与三羧酸循环产能,又为脂肪酸、胆固醇等生物大分子合成提供原料;
直接表观遗传底物:作为乙酰基团的唯一供体,直接参与组蛋白乙酰化修饰,调控染色质结构与基因转录。
因此,乙酰辅酶A的细胞内浓度、亚细胞定位(线粒体、胞质、细胞核)及其动态变化,构成了将代谢状态信号转化为表观遗传指令的分子桥梁。癌细胞通过劫持这一桥梁,实现了代谢重编程对基因表达的“远程控制”。
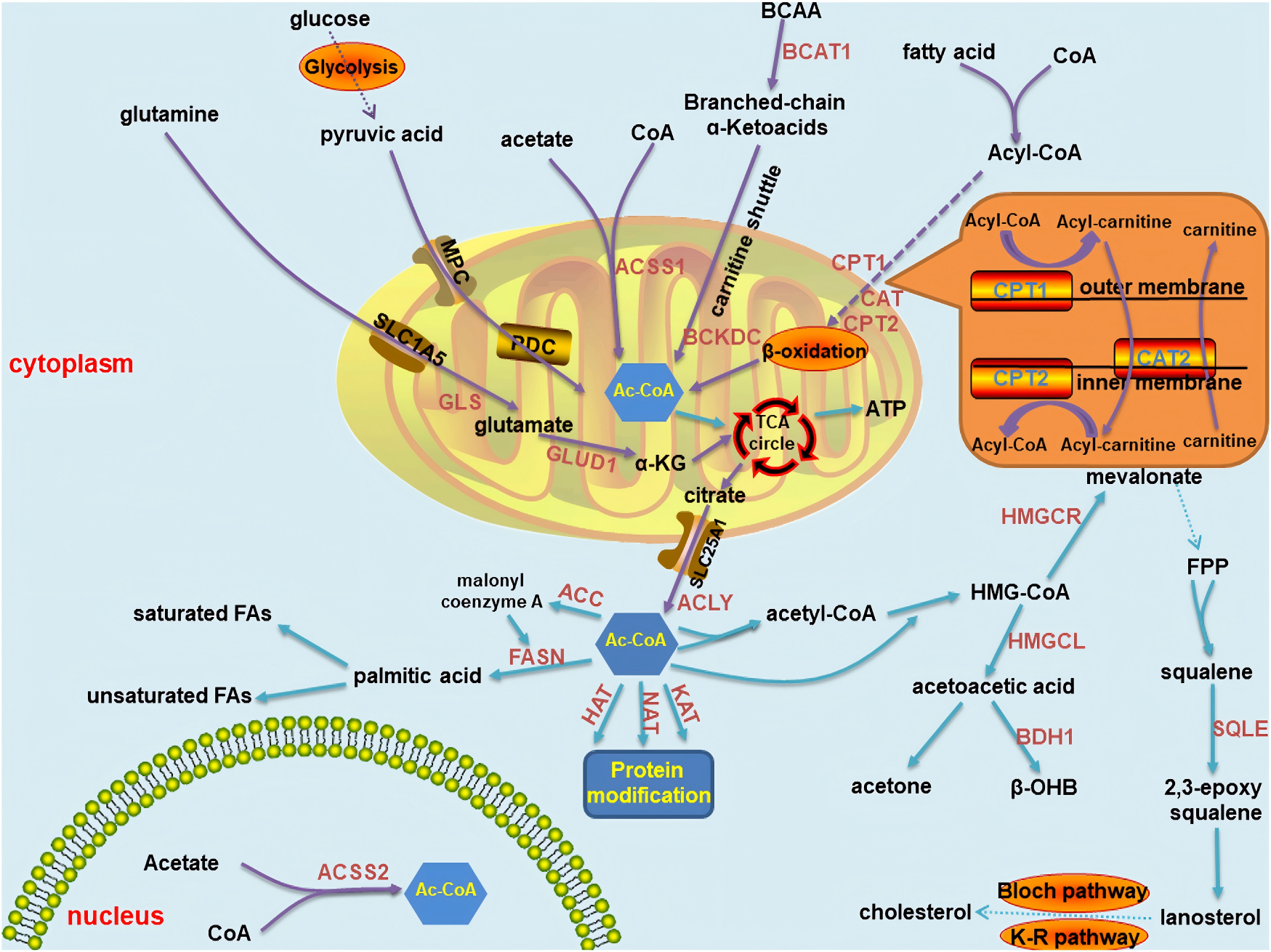
二、癌症代谢重编程重塑乙酰辅酶A稳态与分布
与正常细胞相比,癌细胞对乙酰辅酶A的代谢逻辑进行了根本性重构,核心目标是确保生物合成原料和表观遗传调控基础的持续供应。
1. 区室化分布的根本改变
正常细胞:乙酰辅酶A主要集中于线粒体,90%以上用于氧化磷酸化产生ATP,满足基础生命活动需求;
癌细胞:尽管存在“瓦博格效应”(有氧糖酵解),但通过复杂重编程,优先维持并扩充细胞核与细胞质中的乙酰辅酶A池——核内乙酰辅酶A浓度较正常细胞升高2.5-3倍,为快速增殖所需的脂质从头合成,以及驱动促癌基因转录的组蛋白乙酰化,提供充足的“乙酰基”燃料。
2. 关键合成通路的特异性激活
癌细胞并非简单增加产量,而是智慧切换和强化特定合成途径以适应缺氧、酸中毒等独特微环境,形成“主通路+备用通路”的双重保障:
ACLY通路(“柠檬酸-乙酰辅酶A”轴)
机制:线粒体中的柠檬酸被转运至胞质,由ATP-柠檬酸裂解酶(ACLY)裂解,直接生成乙酰辅酶A和草酰乙酸;
临床意义:ACLY在乳腺癌、胰腺癌、肺癌、前列腺癌等多种实体瘤中显著高表达——三阴性乳腺癌中ACLY表达量较正常组织升高3.2倍,且高表达患者5年生存率降低40%,是癌细胞在营养充足时获取核内乙酰基的主要来源。
ACSS2通路(“乙酸回收”轴)
机制:在肿瘤微环境常见的缺氧、葡萄糖匮乏条件下,癌细胞通过乙酰辅酶A合成酶2(ACSS2),直接捕获并利用微环境中累积的乙酸(来自坏死细胞或肠道菌群)合成乙酰辅酶A;
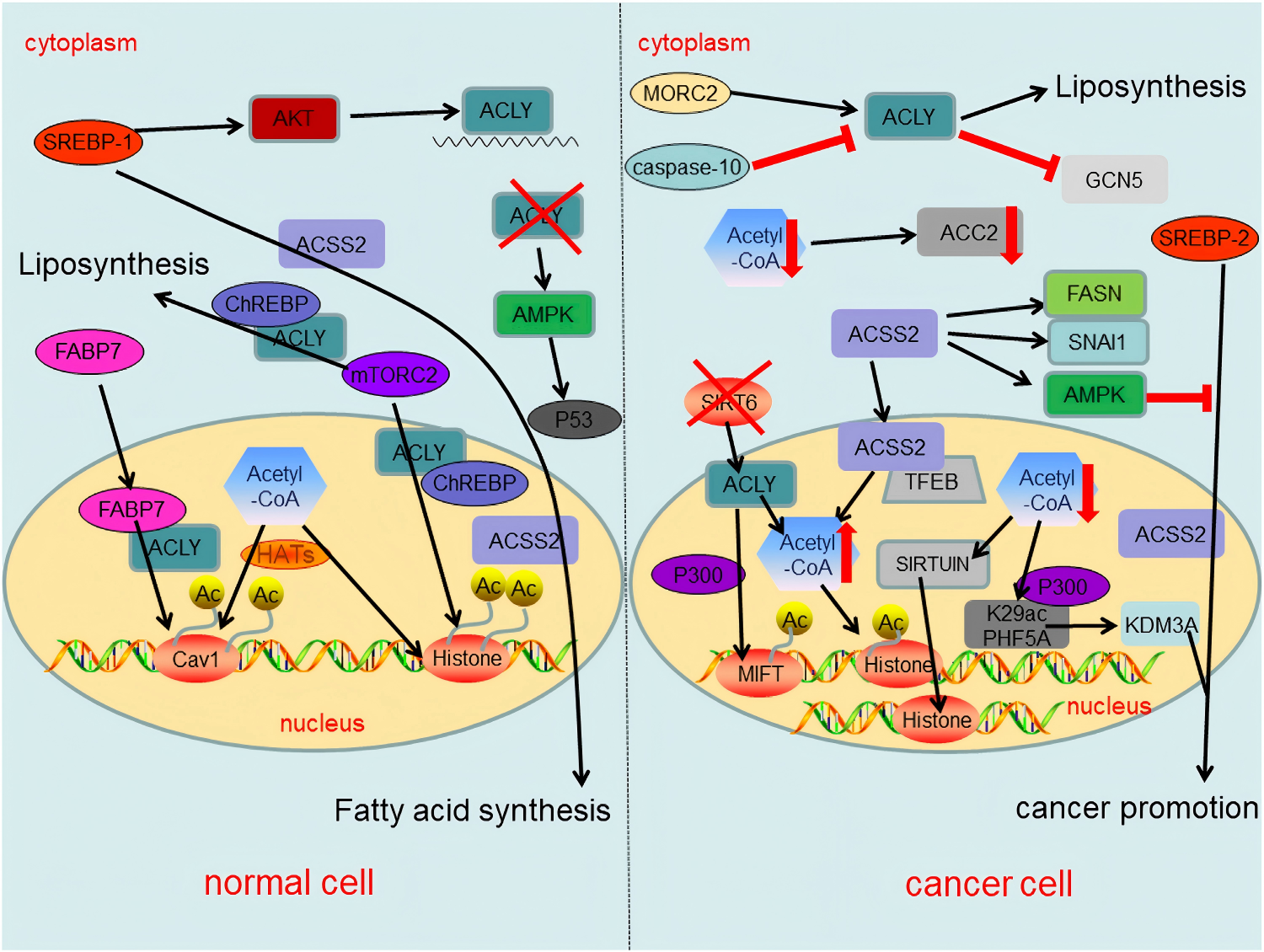
临床意义:这一补偿性通路在胶质母细胞瘤、三阴性乳腺癌等侵袭性肿瘤中被强烈激活,缺氧条件下ACSS2介导的乙酰辅酶A合成占癌细胞总合成量的60%以上,且ACSS2可入核局部产生乙酰辅酶A,直接促进特定基因启动子的组蛋白乙酰化。
3. 微环境驱动的代谢适应性
癌细胞对乙酰辅酶A的调节展现出强大适应性:葡萄糖剥夺时,ACSS2通路快速上调;细胞核内SIRT6失活会导致ACLY积累,使核内乙酰辅酶A池扩大30%以上,进而驱动上皮-间质转化(EMT)相关基因的乙酰化与表达,促进转移。
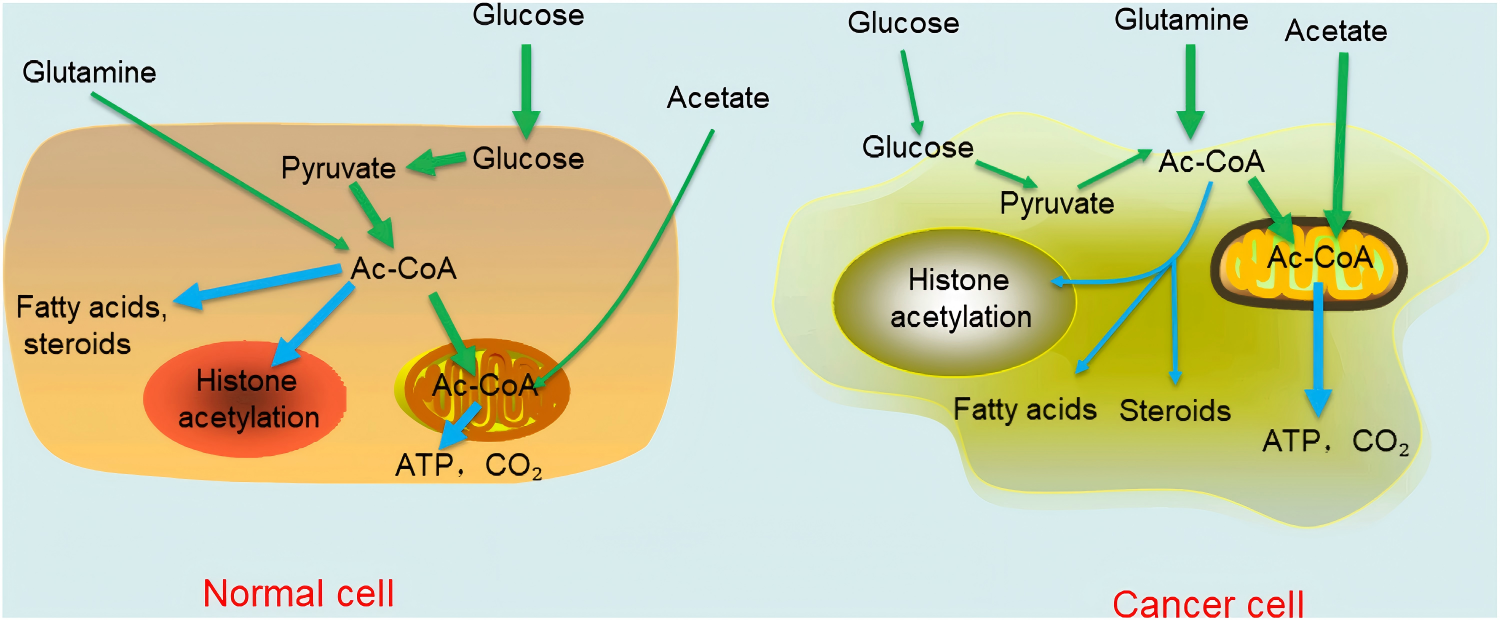
三、乙酰辅酶A驱动的表观遗传机制与靶向治疗策略
升高的核内乙酰辅酶A水平,直接重塑了癌细胞的“组蛋白乙酰化编码”,驱动表型的发展。
1. 驱动肿瘤发生的表观遗传机制
作为不可或缺的乙酰基供体,乙酰辅酶A通过组蛋白乙酰转移酶(HATs,如p300/CBP),在特定基因启动子区催化组蛋白尾部的赖氨酸乙酰化(如H3K9ac、H3K27ac、H3K18ac)。这一过程中和组蛋白正电荷,降低其与DNA的亲和力,使染色质结构松散,进而激活与脂肪合成(如FASN)、细胞周期进程、糖酵解、EMT及干细胞特性相关的整套促癌基因程序,为癌细胞的增殖、存活、转移和耐药提供转录基础。
2. 靶向该轴心的治疗策略
干预“乙酰辅酶A-组蛋白乙酰化”轴已成为极具前景的抗癌新策略,主要分为两大方向:
靶向上游代谢酶
ACLY抑制剂:天然产物羟基柠檬酸(HCA)与α-硫辛酸联用,可使肺癌模型肿瘤体积缩小58%;合成化合物SB-204990对前列腺癌的增殖抑制率达72%,目前ACLY抑制剂BMS-303141已进入临床I期,晚期肝癌患者客观缓解率达18%,且无严重肝毒性;
ACSS2抑制剂:VY-3-135在低浓度(1μmol/L)下即可抑制乳腺癌肿瘤生长,最新开发的四唑类衍生物对胶质母细胞瘤的抑制效果提升40%;
ACC抑制剂:BAY ACC002可减缓胰腺癌在体内外的增殖,螺戊酰胺衍生物通过提高线粒体氧化速率,使结直肠癌肿瘤生长抑制率达65%。
靶向下游修饰酶
组蛋白去乙酰化酶抑制剂(HDACi):伏立诺他、帕比司他在T细胞淋巴瘤中已获批应用,与卡铂、紫杉醇联用治疗晚期上皮性卵巢癌时,总体缓解率达43%;
新兴技术:PROTAC技术已用于开发ACSS2靶向降解剂,在胶质母细胞瘤模型中,较传统抑制剂的肿瘤抑制率提升25%,且脱靶效应显著降低。
3. 新兴的表观遗传生物标志物
特定的组蛋白乙酰化修饰模式正展现出液体活检生物标志物的巨大潜力:
H3K18ac的低乙酰化水平,与乳腺癌、肝细胞癌患者的不良预后独立相关,在肝癌中的阳性预测值达78%,可作为术后复发风险的独立预测因子;
H2BK120ac、H3.3K18ac在肝癌患者中乙酰化水平升高,与较差的生存率和更高的复发率显著相关,其联合检测可将预后评估准确率提升至82%。
这类标志物可用于癌症早期筛查、预后分层,以及靶向乙酰化通路治疗疗效的动态监测。
四、总结与未来展望
本综述系统阐明,乙酰辅酶A绝非普通代谢中间体,而是癌细胞中整合代谢与表观遗传的核心枢纽。癌细胞通过精密的代谢重编程,确保核内乙酰基的持续、特异性供应,从而“重写”组蛋白乙酰化图谱,激活维持其生存与扩张的完整转录程序。这为我们理解癌症提供了“代谢-表观遗传”交互的新维度,也为抗癌治疗开辟了全新赛道。
未来展望与挑战
精准靶向:开发组织特异性抑制剂,区分癌细胞与正常细胞的代谢依赖(如靶向肿瘤特异激活的ACSS2通路),降低全身毒性;
联合治疗策略:深入探索代谢抑制剂(ACLYi/ACSS2i)与表观遗传药物(HDACi、BETi)、免疫疗法的协同机制,设计“代谢阻断+表观重编程+免疫激活”的三联方案,克服耐药;
动态监测与精准医疗:推进乙酰化标志物的液体活检临床转化;
拓展机制研究:深入探索乙酰辅酶A介导的非组蛋白乙酰化修饰,挖掘癌症发病机制的新层面。
乙酰辅酶A介导的“代谢-表观遗传对话”,不仅揭示了癌症发病机制的新维度,更开辟了通过“切断异常代谢燃料供应”与“重编程致癌表观遗传记忆”双管齐下对抗癌症的全新治疗范式。这是一个充满机遇与挑战的前沿交叉领域,值得我们持续关注和探索。




