人体肠道中存在数量繁多的微生物,这些微生物群落称为肠道菌群,肠道菌群包含500到1000种不同的细菌,基因总数是人类的100多倍。人体肠道细菌的总重量可达1-1.5公斤。我们日常排泄物中超过50%的干重是由细菌和它们的“尸体”构成的。肠道菌群通过参与人体的消化吸收、代谢与免疫系统等多种重要生理过程从而影响人体的生命活动,与人体健康密切相关。肠道菌群与肥胖、糖尿病、肿瘤、免疫系统和神经性疾病等多种疾病有密切关联。近年来,对肠道菌群的研究引起了国内外相关科研工作者的广泛兴趣,与代谢组学一样成为当前科学研究热点之一。目前,肠道菌群研究的主要手段有16s rRNA微生物菌群多样性高通量测序、代谢组学和蛋白组学,系统生物学分析为肠道菌群研究分析的快速发展提供了极大推动作用。
谱领生物提供领先的基于代谢组学、高通量测序技术的肠道菌群研究综合解决方案。
非靶向代谢组学是以组学的视角无偏向性地检测所有的内源性小分子代谢物,采用生物信息学手段研究生物体受到扰动(如基因改变或环境变化)后内源性代谢物的整体代谢特征或变化规律,发现导致这种代谢差异的内源性小分子代谢物(潜在的生物标志物)和探索引起这种生命现象或病理现象背后的代谢机制。非靶向代谢组学已成为后基因组学时代功能基因组学的研究利器,是大规模筛选用于疾病的早期预测、诊断和分型的新生物标志物的重要手段,是精准医学的重要技术手段之一。
对于肠道菌群参和宿主代谢物进行精准检测分析,寻找肠道微生物的代谢组的差异和变化,可以更加直接呈现肠道菌群—宿主的代谢状态,对于进而研究其背后的生理或病理机制具有重大意义。
采用16s rRNA微生物菌群多样性高通量测序技术对肠道内容物或粪便样本中的微生物进行测序并进行分析,获取肠道菌群的菌群种属、丰度和分布等信息。在基因水平上获取肠道菌群的详细信息。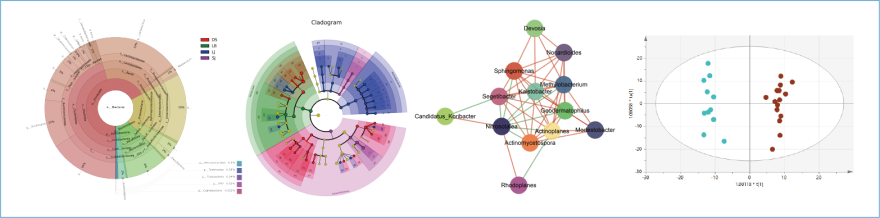
通过对宿主肠道内容物或粪便样本进行代谢组学检测分析,进而研究肠道菌群和宿主在代谢水平上的相互作用。不同设计和需求又需要使用不同的代谢组学方法:
人体内短链脂肪酸主要由未消化吸收的碳水化合物经结肠厌氧菌酵解产生,主要包括乙酸、丙酸、丁酸等。短链脂肪酸在结肠腔内不仅可作为肠粘膜细胞的主要能量来源,还可以减少促炎因子的生成,降低结肠炎症的发生;更重要的是,短链脂肪酸对肿瘤细胞的增殖起到抑制作用,并诱导肿瘤细胞分化和凋亡,降低瘤变的几率。
肠道菌群能产生包括如γ-氨基丁酸、多巴胺和5-羟色胺等在内的对体内系统发出信号的神经递质类化合物,这些神经递质对人的精神、行为活动会产生不同的影响。
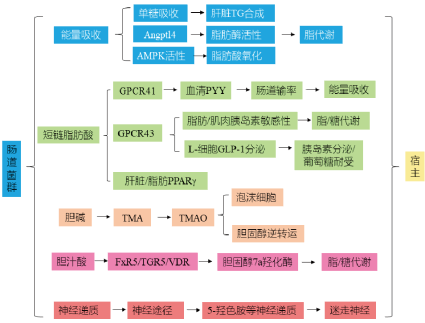
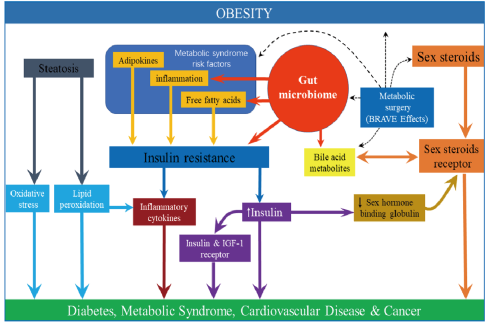
肠道菌群和胆汁酸代谢在肥胖、糖尿病、非酒精性脂肪肝病等疾病的发生和发展过程中均发挥了关键作用。近年来胆汁酸代谢与肠道菌群的研究逐渐深入,肠道细菌在胆汁酸的生物转化、肝脏胆汁酸的合成、肠道胆汁酸的重吸收等过程中具有重要作用。
肠道菌群与氧化三甲胺(TMAO)代谢密切关联。含有胆碱或三甲胺结构的食物,如磷脂酰胆碱(PC)、左旋肉碱和某些海水鱼类等,经过肠道的消化吸收和肠道菌群作用后可代谢为三甲胺(TMA)。TMA进一步被肝脏分泌的黄素单氧酶3(FMO3)或者其他黄素单氧酶(FMOx)迅速氧化为TMAO。
体内TMAO水平与糖尿病、癌症、心血管疾病、心肌梗死、高血压、高血脂和部分肾病等均有密切关联。
Chang H.K. Microbiota or short-chain fatty acids: which regulatesdiabetes. Cellular & Molecular Immunology. 2017, 15:88-91.
Williams B.B., Van Benschoten A.H., Fischbach M.A., et al. Discovery and characterization of gut microbiota decarboxylases that can produce the neurotransmitter vtryptamine. Cell Host & Microbe. 2014, 16:495-503.
Gu Y., Wang X., Ning G., et al. Analyses of gut microbiota and plasma bile acids enable stratification of patients for antidiabetic treatment. Nature Communications. 2017, 8:1785.
Zhu W., Gregory J.C., Hazen S.L., et al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016, 165:111-124.
Liu R., Hong J., Wang W., et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nature Medicine. 2017, 23:859-868.
Chang H.K. Microbiota or short-chain fatty acids: which regulatesdiabetes. Cellular & Molecular Immunology. 2017, 15:88-91.
Williams B.B., Van Benschoten A.H., Fischbach M.A., et al. Discovery and characterization of gut microbiota decarboxylases that can produce the neurotransmitter vtryptamine. Cell Host & Microbe. 2014, 16:495-503.
Gu Y., Wang X., Ning G., et al. Analyses of gut microbiota and plasma bile acids enable stratification of patients for antidiabetic treatment. Nature Communications. 2017, 8:1785.
Zhu W., Gregory J.C., Hazen S.L., et al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016, 165:111-124.
Liu R., Hong J., Wang W., et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nature Medicine. 2017, 23:859-868.