通过在一个或多个氨基酸残基上加上修饰基团,可以改变蛋白质的物理、化学性质进而影响蛋白质的空间构象、活性、亚细胞定位、蛋白质折叠以及蛋白质-蛋白质相互作用。包括磷酸化、糖基化、乙酰化、泛素化、丙酰化、丁酰化、丙二酰化、戊二酰化、琥珀酰化、单甲基化、二甲基化、三甲基化等。
磷酸化蛋白组;
糖基化蛋白组;
乙酰化蛋白组;
泛素化蛋白组等。
蛋白质磷酸化是一种非常重要且广泛存在于原核生物和真核生物中的翻译后修饰调控方式,参与细胞的增殖、发育、分化、凋亡,细胞骨架调控、神经活动、肌肉收缩、新陈代谢及肿瘤发生等,对许多生物的细胞功能起着生物“开/关”作用。研究磷酸化蛋白质组,解析生命体复杂多样的生理和病理过程。
蛋白质乙酰化参与了几乎所有的生物学过程,如转录、应激反应、新陈代谢以及蛋白合成与降解等,除了影响细胞染色体结构以及对核内转录调控因子的激活外,对蛋白质的功能也可以产生很大的影响,包括酶的活化与失活,蛋白质稳定性,亚细胞结构定位和特殊功能复合体的形成等。研究乙酰化蛋白质组,解析生命体复杂多样的生理和病理过程。
蛋白质琥珀酰化(Succinylation)修饰是指琥珀酰基团供体,如琥珀酰辅酶A,通过酶学或者非酶学的方式将琥珀酰基团共价结合到底物蛋白质的赖氨酸残基上的过程。琥珀酰化修饰赋予赖氨酸基团2个负电荷,能够引发更多蛋白质特性的改变,且琥珀酰基团空间结构较大,对于蛋白质结构和功能的影响更为显著。
琥珀酰化日益成为当前研究热度较高的一种新的翻译后修饰类型,文章发表数量也逐年增加。
蛋白质丙酰化(Propionylation)修饰指在酰基转移酶(如乙酰基转移酶)的作用下催化丙酰基团(如丙酰辅酶A等供体)共价结合到底物蛋白质中赖氨酸残基上的过程。赖氨酸丙酰化修饰是酰化修饰的重要组成部分,相关研究文章至今已有近80篇,并逐年递增。
蛋白质泛素化修饰是一种重要的翻译后修饰,在蛋白质的定位、代谢、功能调节和降解中都起着十分重要的作用。同时,它也参与了细胞周期、增殖、凋亡、分化、转移,基因表达、转录调节、信号传递、损伤修复、炎症免疫等几乎一切生命活动的调控。泛素化与肿瘤、神经退行性病变、肌肉营养不良、免疫疾病、心血管疾病以及代谢综合症的发病密切相关。
糖基化调控了蛋白质在组织和细胞中的定位、功能、活性、寿命和多样性,参与细胞的识别、分化、发育,信号传导、免疫应答等在内的各种重要的生命活动。在各种疾病,如肿瘤、神经退行性疾病、心血管病、代谢性疾病、免疫性疾病及感染性疾病的发生发展中,均伴随着蛋白质糖基化异常的发生。
多通路磷酸化(Multi-pathway)是一款基于质谱的信号通路全景筛查产品。相应的抗体可富集并定性定量至少 800 种已知的蛋白和至少 4000 个磷酸化位点,涵盖 19 条经典的信号通路,是样本中靶蛋白高通量筛选和检测的稳健方法。


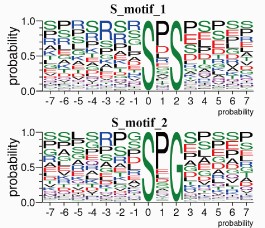
motif分析
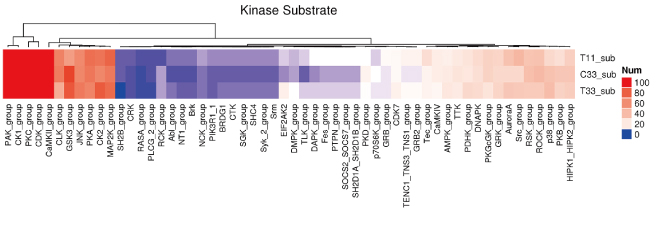
磷酸化激酶统计图
差异蛋白火山图
GO富集分析
差异蛋白KEGG富集气泡图
横坐标为相应通路中差异蛋白的数目与鉴定出的总蛋白数目的比值,值越大,说明在该通路中差异蛋白富集程度较高。点的颜色代表超几何检验的 P-value值,值越小,说明检验的可靠性越大、越具统计学意义。点的大小代表相应通路中差异蛋白的数目,越大,该通路中差异蛋白就越多。

典 型 案 例
磷酸化蛋白质组揭示昼夜节律调控机制
Phosphorylation Is a Central Mechanism for Circadian Control of Metabolism and Physiology
期刊:Cell Metabolism
影响因子:18.164
发表单位:马克斯普朗克研究所
发表时间:2017.01
生物钟,作为生物体内一种无形的时钟,控制着生物体内几乎全部的代谢过程,并且其自身会不断优化以保证生物体的稳态和代谢健康。生物钟节律的紊乱会导致一系列的疾病,如糖尿病、肥胖和代谢疾病。研究生物钟,在医学上有着重要的意义,并对生物学的基础理论研究起着促进作用。许多研究已经利用转录组和蛋白质组技术研究了昼夜节律,但是磷酸化蛋白质组尚未涉及。

1. 体内大规模昼夜磷酸化蛋白质组
小鼠肝脏组织中共鉴定到20,404个磷酸化肽段,20,076个磷酸化位点,4,461个磷酸化蛋白,且定量重复性较高。
2. 小鼠肝脏磷酸表达水平每天大幅度振荡
其中27%的磷酸化肽段,41%的磷酸化蛋白表达水平 在2天内发生大幅度变化(图1A)。表达水平聚类分析,可以将磷酸化肽段分为光照和黑暗两大类(图 1B)。PCA分析表明,磷酸化蛋白质组循环周期为一 天(图1C)。肝脏磷酸化蛋白质富集到不同代谢通路,表明翻译后修饰在昼夜节律调控中起着关键作用 (图1 D)。蛋白质表达量和磷酸化蛋白表达量均随昼夜节律振荡,但是磷酸化蛋白质表达量振荡幅度更大(图 2A,图2B)。蛋白质表达水平平均差异倍数为1.2,磷酸化蛋白质表达水平平均差异倍数为5倍(图 2C)。FC值累计曲线表明,80%的磷酸化累积强度来自于20%的磷酸化水平振荡的肽段,表明磷酸化水平变化的蛋白为调控蛋白而非结构蛋白(图2D)。
3. CLOCK蛋白上氨基酸位点的磷酸化循环
小鼠肝脏中CRY1 S588和CRY2 S557分别在 CT0和CT21表达量达到峰值(图3A)。在 CLOCK蛋白上发现了新的磷酸化位点S446和 S440/441,其磷酸化水平也出现周期性的变化(图3B),这些氨基酸残基位于蛋白质序列中富含丝氨酸的区域,在哺乳动物中高度保守(图3C)。CLOCK磷酸化突变体转录活性 低于野生型,然而CRY1介导的转录抑制不受影响(图3D,图3E)。结果表明,CLOCK蛋白上的S440 / S441和S446的体内磷酸化循环在不含CRY1介导的抑制的情况下即可调节其转录活性。
4. 昼夜节律中小鼠肝脏激酶活性调控
激酶富集分析结果表明,ERK底物和AK- T/mTOR底物磷酸化水平在白天和晚上分别达到峰值(图4A)。与 EGFR-RAS-ERK-RSK级联反应相关的激酶磷酸化水平在白天达到峰值,这些酶多为糖酵解,糖原合成和脂肪合成的限速酶,使得小鼠在食物摄入最少的时候促进糖酵解提供能量,抑制糖原和脂肪的合成。与 insulin-AKT-mTOR 级联反应相关酶的磷酸化水平在夜晚达到峰值,此时小鼠活动活跃,营养充足,使得脂肪合成、生长相关的代谢途径比较旺盛(图4 B)。