什么是酰基辅酶A?
辅酶A,英文名为Coenzyme A,简写为CoA、SCoA或CoASH,它由腺苷三磷酸核苷酸(不同于ATP)、泛酸和半胱胺共三个部分组成的一个重要代谢分子,该分子的半胱胺上的硫原子在代谢上极其重要,它与羧酸反应形成酰基硫酯类衍生物(酰基辅酶A),这种酰基辅酶A在代谢转化中扮演重要的活性酰基基团载体的角色。辅酶A是众多生化反应中至关重要的辅因子,在脂肪酸合成、氧化和丙酮酸氧化中具有重要作用。辅酶A来源于B族维生素泛酸,泛酸可从饮食中获取或在体内合成。包含酰基辅酶A在内的硫酯类物质是细胞代谢的关键中间代谢产物。酰基辅酶A是指由脂肪酸或其他含有羧基的化合物分子与辅酶A(CoA)结合形成的一类分子。酰基辅酶A分子的特征在于其酰基,该酰基可以是不同长度的脂肪酸。酰基辅酶A类物质来源于多个途径,如糖酵解、柠檬酸循环,β-氧化和支链氨基酸降解代谢。作为酶促反应的载体,是体内70多种酶反应通路的辅助因子,是能源物质代谢的重要中间代谢产物,广泛存在于动物、植物、微生物和培养细胞中,在体内能源物质代谢中是一个枢纽性的物质。作为酰基载体,酰基辅酶A能参与蛋白质的化学反应,包括组蛋白修饰导致染色质生物学调控。酰基辅酶A类物质在脂肪酸代谢、氨基酸代谢、三羧酸循环以及类异戊二烯合成(isoprenoid biosynthesis)的甲羟戊酸途径(mevalonate pathway)的初始反应中的重要中间产物。
乙酰辅酶A的功能
乙酰辅酶A是细胞代谢中的关键中间产物,在多种代谢过程中发挥着关键作用。它不仅是众多分解代谢反应的产物,还是脂质生物合成的起始代谢物,对于细胞生长和增殖具有重要作用。作为蛋白质乙酰化修饰反应的底物,细胞内乙酰辅酶A的水平与组蛋白(histone)和转录因子的乙酰化水平动态相关,在表观遗传调控和其他细胞过程中发挥着重要作用。乙酰辅酶A是丙酮酸脱羧、脂肪酸β-氧化的产物。丙酮酸进入线粒体基质后氧化脱羧,随后被丙酮酸脱氢酶复合体(Pyruvate dehydrogenase complex, PDC)转化为乙酰辅酶A,因此,丙酮酸是脂肪酸合成、胆固醇合成和生酮作用的碳源。三大营养物质的彻底氧化殊途同归,都会生成了乙酰辅酶A,进入三羧酸循环,最终形成ATP。
乙酰辅酶A(Acetyl-CoA)主要分布于细胞的线粒体(mitochondria)、细胞核(nucleus)和细胞质(cytoplasm)。线粒体乙酰辅酶A通常被视为一个相对独立的组分,而细胞核和细胞质中的乙酰辅酶A则被视为一个整体,称为核质组分。现有研究表明,线粒体或核质组分中乙酰辅酶A水平的变化会影响组蛋白的乙酰化水平。乙酰辅酶A是组蛋白乙酰转移酶(histone acetyltransferases, HATs)的重要辅因子,乙酰辅酶A与辅酶A(CoA)的比例可调节HATs的酶活性和特异性。乙酰辅酶A的含量水平调节重要的细胞过程如能量代谢、脂质合成和降解、蛋白质乙酰化,甚至细胞自噬(autophagy)。
线粒体酰基辅酶A代谢
线粒体酰基辅酶A代谢对于细胞能量生成至关重要。它通过线粒体中的丙酮酸脱氢酶(pyruvate dehydrogenase)的作用,从丙酮酸生成乙酰辅酶A。乙酰辅酶A是线粒体中多种代谢途径的核心枢纽,包括三羧酸(TCA)循环,该循环为ATP生成提供还原当量。此外,乙酰辅酶A还参与脂肪酸和其他重要分子的生物合成。脂肪酸合成以乙酰辅酶A为底物,由乙酰辅酶A羧化酶(acetyl-CoA carboxylase)将其转化为丙二酰辅酶A,后者进一步加工生成长链脂肪酸。来源于脂肪酸的酰基辅酶A分子也参与线粒体β-氧化,这是一个分解脂肪酸以产生能量的过程。酰基辅酶A脱氢酶(acyl-CoA dehydrogenase)等酶促进不同链长酰基辅酶A分子的氧化。与线粒体酰基辅酶A代谢相关的酶存在遗传性缺陷可导致脂肪酸氧化障碍,其特征是脂肪酸分解受损,随后有毒代谢产物积聚,从而导致各种临床症状。
细胞质酰基辅酶A代谢
在细胞质中,酰基辅酶A代谢主要与脂肪酸的合成和代谢相关。脂肪酸可以从饮食中获取,或在体内从头合成。但无论来源如何,脂肪酸在用于各种代谢过程之前都需要被激活。脂肪酸的活化是通过一种名为脂肪酰辅酶A合成酶(fatty acyl-CoA synthetase)或也称为脂肪酸硫激酶(fatty acid thiokinase)的酶的作用来实现的。脂肪酰辅酶A合成酶通过将脂肪酸与辅酶A(CoA)连接,催化ATP依赖的脂肪酰辅酶A分子的形成。由此产生的脂肪酰辅酶A分子随后可用于进一步的代谢反应。
一旦被激活,脂肪酰辅酶A分子可根据细胞的能量需求和代谢状态经历不同的代谢命运。如前所述,它们可以进入线粒体β-氧化过程,在此过程中被分解产生乙酰辅酶A并生成能量。或者,脂肪酰辅酶A分子可用于合成复杂的脂质,如磷脂、甘油三酯和胆固醇酯,这些是细胞膜和脂滴的重要组成部分。
脂肪酸还可以通过延长或去饱和反应,生成具有特定功能的多种脂肪酸种类。这些反应发生在内质网(endoplasmic reticulum)中,分别涉及脂肪酸延长酶(fatty acid elongase) 和去饱和酶(desaturase)。酰基辅酶A分子作为这些酶促反应的底物,有助于生成不同链长和不同不饱和度的脂肪酸。
细胞质酰基辅酶A(CoA)的代谢调控受到严格控制,以维持细胞内环境的稳定。参与脂肪酸合成的酶,如乙酰辅酶A羧化酶和脂肪酸合酶,受到激素和营养信号的精细调控。底物(如乙酰辅酶A和丙二酰辅酶A)的可用性以及细胞的能量状态,都会影响这些酶的活性以及脂肪酸合成和代谢的整体平衡。
酰基辅酶A分析在研究中的应用
酰基辅酶A(Acyl-CoA)分析在科学研究中发挥着至关重要的作用,它为研究细胞代谢及其在各种疾病中的失调提供了宝贵的见解。准确测量和表征酰基辅酶A种类对于理解代谢途径、识别生物标志物以及评估治疗干预措施至关重要。
1. 代谢特征分析和途径分析
酰基辅酶A(Acyl-CoA)分析能够全面剖析不同细胞区室和组织中的酰基辅酶A种类。通过采用基于质谱的方法,研究人员可以识别和量化特定的酰基辅酶A分子,从而快速了解细胞或生物体的代谢状态。这种剖析有助于阐明代谢途径并识别关键的调控步骤,从而促进对细胞代谢的深入理解。
2. 疾病生物标志物的发现
酰基辅酶A(Acyl-CoA)代谢的改变与多种代谢紊乱相关,包括脂肪酸氧化障碍、肥胖、糖尿病和癌症。对酰基辅酶A种类的分析有助于识别特定疾病的代谢特征和潜在生物标志物。通过比较健康个体和患病个体之间的酰基辅酶A谱系,研究人员可以发现反映特定代谢途径失调的新型生物标志物。这些生物标志物有望用于疾病的早期检测、疾病进展的监测以及治疗反应的评估。
3. 药理研究
酰基辅酶A(Acyl-CoA)分析对于评估靶向代谢途径的药物的疗效和安全性具有不可估量的价值。研究人员可以通过评估药物干预对酰基辅酶A谱的影响,来确定药物对特定代谢途径的作用以及潜在的脱靶效应。这些信息有助于优化药物剂量、开发个性化疗法,以及识别潜在的药物相互作用。
4. 机制研究
研究酰基辅酶A(Acyl-CoA)代谢有助于深入了解代谢性疾病和障碍的潜在机制。通过调控酰基辅酶A代谢中涉及的特定酶或途径,研究人员可以探究酰基辅酶A水平或分布改变所带来的影响。这些机制研究有助于揭示代谢紊乱的分子基础,进而为制定靶向治疗策略做出贡献。
5. 营养与膳食研究
酰基辅酶A(Acyl-CoA)分析在了解营养和饮食干预对细胞代谢的影响方面发挥着关键作用。研究人员可以评估酰基辅酶A谱系在不同饮食成分(如脂肪、碳水化合物或特定营养素)作用下的变化。该分析有助于阐明饮食因素对代谢途径的影响,并为制定促进健康和预防疾病的个性化饮食建议做出贡献。
研究酰基辅酶A的分析方法
酰基辅酶A(Acyl-CoA)及其代谢途径的准确检测和定量需要可靠的分析方法。质谱(MS)已成为酰基辅酶A分析中一种高度敏感且特异的工具。为研究酰基辅酶A,已开发出多种基于质谱的方法,包括:
(1)液相色谱-质谱(LC-MS)结合了液相色谱的优秀分离能力和质谱的检测能力,能够分离和检测不同种类酰基辅酶A(acyl-CoA),包括同分异构体。LC-MS用途广泛,在代谢组学研究中已得到广泛应用。它能够识别和定量复杂生物样本中存在的不同酰基辅酶A物种,因此适用于酰基辅酶A代谢的全面分析。
(2)串联质谱(MS/MS)涉及连续使用两个质谱仪来提供被分析分子的结构信息。通过使酰基辅酶A(acyl-CoA)分子发生碎裂,MS/MS有助于识别和区分各种酰基辅酶A分子。该技术对于研究酰基辅酶A异构体或区分质量相似的不同酰基辅酶A分子特别有用。为了精确测量酰基辅酶A(acyl-CoA)种类,同位素稀释质谱法(IDMS)使用稳定同位素标记的内标(同位素内标)。IDMS通过比较内源性酰基辅酶A种类与同位素内标的信号,能够准确估算酰基辅酶A的浓度。由于其高准确性和可靠性,该技术非常适用于生物样本中酰基辅酶A水平的定量分析和评估。
(3)高分辨率质谱(HRMS)提供了更高的质量准确度和分辨能力,能够精确测定和表征酰基辅酶A(acyl-CoA)。它对于鉴定和分析具有复杂结构或修饰的酰基辅酶A分子特别有用。HRMS对于深入探究酰基辅酶A代谢和检测微妙的代谢变化具有重要价值。
] 酰基辅酶A类物质定量
辅酶A由腺苷三磷酸核苷酸(不同于ATP)、泛酸和半胱胺共三个部分组成的一个重要代谢分子,该分子的半胱胺上的硫原子在代谢上极其重要,因为它与羧酸反应形成酰基硫酯类衍生物(酰基辅酶A),这种酰基辅酶A在代谢转化中扮演重要的活性酰基基团载体的角色。
酰基辅酶 A 类物质作为酶促反应的载体,是体内 70 多种酶反应通路的辅助因子,是能源物质代谢的重要中间代谢产物,广泛存在于动物、植物、微生物和培养细胞中,在体内能源物质代谢中是一个枢纽性的物质。酰基辅酶A类物质在脂肪酸代谢、氨基酸代谢、三羧酸循环以及类异戊二烯合成(isoprenoid biosynthesis)的甲羟戊酸途径(mevalonate pathway)的初始反应中的重要中间产物。重要的酰基辅酶A类物质包括(1)乙酰辅酶A(acetyl-CoA),在代谢物合成和分解以及初级和次级代谢过程中极其重要,是蛋白质的乙酰化修饰调控的重要活性分子;(2)丙二酰辅酶A(malonyl-CoA),是脂肪酸和聚酮生物合成的中间体;(3)3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-CoA, HMG-CoA),是甲羟戊酸途径和亮氨酸降解代谢中间体;(4)乳酰辅酶A((Lactyl-CoA),为蛋白质修饰如组蛋白乳酸修饰提供底物;(5)其它各种蛋白质修饰的重要底物,如巴豆酰辅酶A(Crotonyl-CoA)、琥珀酰辅酶A(Succinyl-CoA)、棕榈酰辅酶A(Palmitoyl-CoA)等等。因此,酰基辅酶A类物质在代谢和疾病的研究中具有极其重要的作用。
谱领生物在对生命科学和分析科学方面具有深厚的理论基础和实践经验,在多年研究和服务的基础上建立了成熟、可靠的酰基辅酶A类物质定量和代谢流技术,可一次性对多种酰基辅酶A类物质进行检测分析。适用于各种生物样本,单次检测,便可精确定量多种不同结构的辅酶类的精确含量,检出限最低可达皮克(pg)级别,更加适合高端生命科学研究。
]服务流程
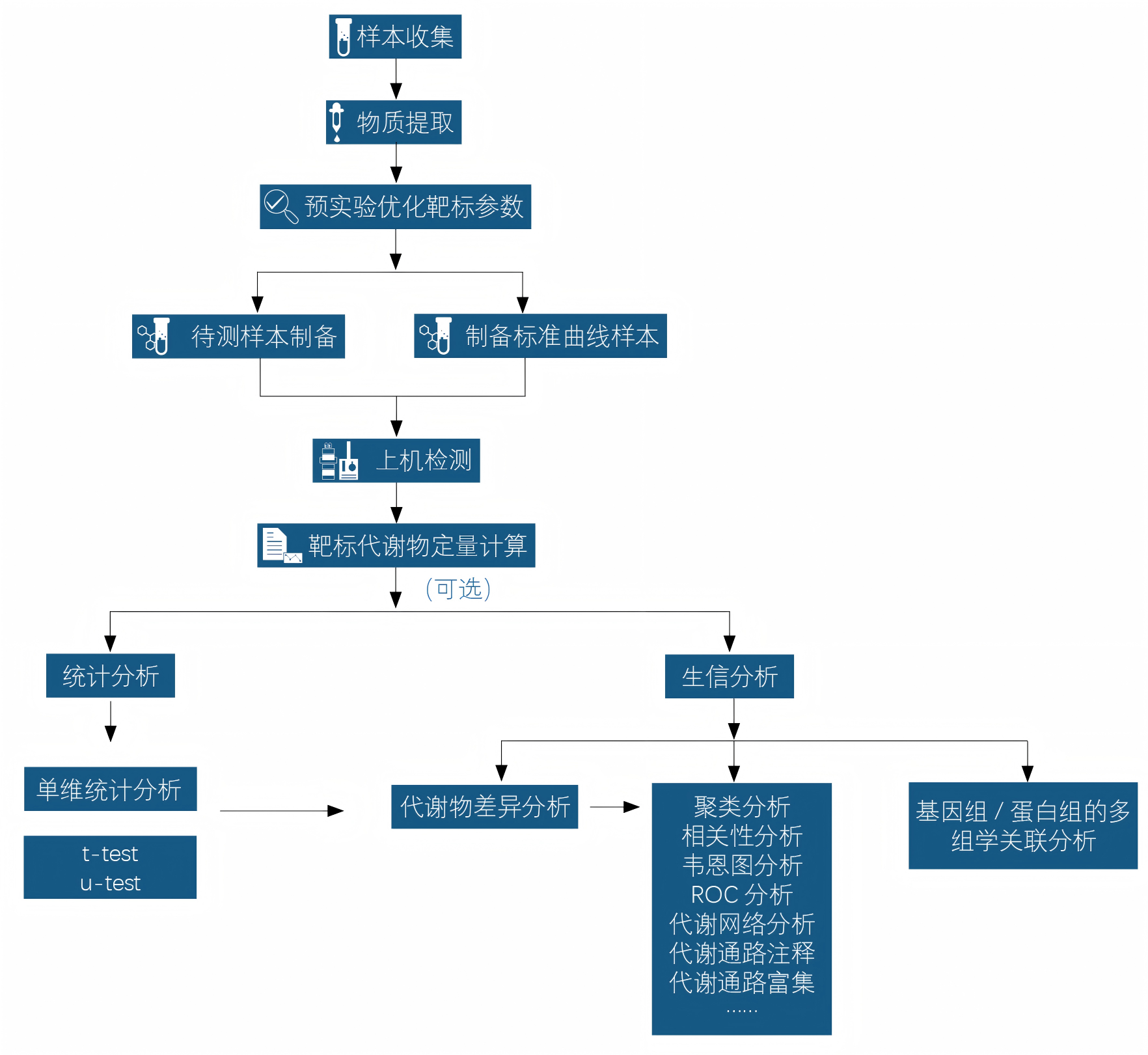
样本量要求
细胞样本:一般不少于一千万细胞(10^7),对于部分特定酰基辅酶A检测,样本可能放宽到一百万细胞或更少;
组织样本:一般不低于20毫克,脂肪组织样本一般不低于100毫克;
植物样本:一般不低于100毫克;
微生物菌体:一般不低于100毫克。
其他类型样本请详询公司技术支持人员。
生物学重复
相较于其他组学,代谢组学更加灵敏,更接近于真实情况。因此,为保证实验结果的可靠性,要求更多的生物学样本重复。我们建议:
临床样本,单组不少于30 例重复;
动物样本,单组不少于9 例重复;
细胞、微生物样本,单组不少于5 例重复;
其他如植物样本,单组不少于7 例重复。
仪器平台
平台一:超高效液相色谱串联质谱联用仪 1290-6470( Agilent UHPLC-MS/MS)
灵敏度更高 — 低至亚飞克级的检测限更清晰的信号和更低的噪音 — 安捷伦喷射流技术采用超热氮气改善离子生成与脱溶剂。可灵活升级为 Agilent iFunnel 技术的安全投资通过弯曲的圆锥形六极杆创新组件进行产物离子的高效采集和传输筛查、确证和定量 — 触发式多反应监测 (tMRM) 结合了快速、灵敏的 MRM 定量分析与产物离子谱图,可用于谱库检索、化合物筛查和确证。
平台二:超高效液相色谱串联质谱联用仪 SCIEX QTrap 7500 质谱系统
业界著名的SCIEX公司的QTRAP 7500质谱系统具有极高的灵敏度和特异性,它具备新离子源、离子路径和软件,显著提升定量分析的灵敏度、工作效率及稳定性将液相色谱串联质谱定量分析进入灵敏度新纪元。OptiFlow™ Pro离子源、E Lens™技术和D Jet™离子导向技术共同提高了灵敏度。MRM扫描的同时结合QTRAP扫描如增强子离子(EPI)扫描获得高质量的MS/MS质谱图,或MRM³有效消除高背景和干扰提供更好的特异性和定量性能,且不会降低仪器的定量灵敏度,将分析物定量到低痕量水平。
平台三:超高效液相色谱高分辨质谱联用仪 Q Exactive ™ HF-X ( Thermo Scientific Orbitrap MS)
搭配 UltiMate ™ 3000 系统,使用 Q Exactive ™ 组合型四极杆 Orbitrap 质谱仪可以快速可靠地识别、定量和确认更多化合物。 本台式 UHPLC-HRMS 系统将四极杆母离子选择性与高分辨率和准确质量数(HRAM)Orbitrap 检测相结合,提供出色性能和多功能性。 Q Exactive 质谱仪特别适用于非目标或目标化合物筛查,也能够实现广泛的定性和定量应用。
服务周期
样本检测:10-15 个工作日;
数据分析:5-7 个工作日;
服务周期自收到预付款、待测样本和客户确认检测要求之日起计算。
应用方向
表型组和生理功能研究;
疾病早期预测和诊断研究;
病理学研究 ;
天然药物和药理研究 ;
中医现代化和理论研究;
食品科学、安全和营养学研究;
畜牧业和农林业研究;
植物学和环境研究;
毒理学研究。
| No | Metabolite | 中文名 | CAS号 | HMDB ID | Class |
| 1 | Coenzyme A (CoA-SH) | 辅酶A | 85-61-0 | HMDB0001423 | 短链脂酰辅酶A |
| 2 | Dephospho-CoA | 3′-脱磷酸辅酶A | 3633-59-8 | HMDB0001373 | 短链脂酰辅酶A |
| 3 | Acetyl-CoA | 乙酰辅酶A | 72-89-9 | HMDB0001206 | 短链脂酰辅酶A |
| 4 | 3-Hydroxy-3-methylglutaryl-CoA (HMG-CoA) | 3-羟基-3-甲基戊二酰辅酶A | 1553-55-5 | HMDB0001375 | 短链脂酰辅酶A |
| 5 | Acetoacetyl-CoA | 乙酰乙酰辅酶A | 1420-36-6 | HMDB0001484 | 短链脂酰辅酶A |
| 6 | Succinyl-CoA | 琥珀酰辅酶A | 604-98-8 | HMDB0001022 | 短链脂酰辅酶A |
| 7 | Methylmalonyl-CoA | 甲基丙二酰辅酶A | 104809-02-1 | HMDB0001269 | 短链脂酰辅酶A |
| 8 | Propionyl-CoA | 丙二酰辅酶A | 317-66-8 | HMDB0001275 | 短链脂酰辅酶A |
| 9 | Crotonoyl-CoA | 巴豆酰辅酶A | 102680-35-3 | HMDB0002009 | 短链脂酰辅酶A |
| 10 | 3-Methylcrotonyl-CoA | β-甲基巴豆酰辅酶A | 6712-03-4 | HMDB0001493 | 短链脂酰辅酶A |
| 11 | Malonyl-CoA | 丙二酰辅酶A | 524-14-1 | HMDB0001175 | 短链脂酰辅酶A |
| 12 | Butyryl-CoA | 丁酰辅酶A | 2140-48-9 | HMDB0001088 | 短链脂酰辅酶A |
| 13 | Isobutyryl-CoA | 异丁酰辅酶A | 15621-60-0 | HMDB0001243 | 短链脂酰辅酶A |
| 14 | 3-Hydroxybutyryl-CoA | β-羟基丁酰辅酶A | 2871-66-1 | HMDB0001166 | 短链脂酰辅酶A |
| 15 | Isovaleryl-CoA | 异戊酰辅酶A | 6244-91-3 | HMDB0001113 | 短链脂酰辅酶A |
| 16 | Glutaryl-CoA | 戊酰辅酶A | 103192-48-9 | HMDB0001339 | 短链脂酰辅酶A |
| 17 | Hexanoyl-CoA | 己酰辅酶A | 5060-32-2 | HMDB0002845 | 短链脂酰辅酶A |
| 18 | Adipoyl-CoA | 己二酰辅酶A | 25119-42-0 | HMDB0004047 | 短链脂酰辅酶A |
| 19 | Lactyl-CoA | 乳酰辅酶A | 1926-57-4 | HMDB0002346 | 短链脂酰辅酶A |
| 20 | 2-Hydroxyisobutanoyl-CoA | 2-羟基异丁酰辅酶A | 1383119-39-8 | 短链脂酰辅酶A | |
| 21 | Octanoyl-CoA | 辛酰辅酶A | 1264-52-4 | HMDB0001070 | 中长链脂酰辅酶A |
| 22 | Decanoyl-CoA | 癸酰辅酶A | 1264-57-9 | HMDB0006404 | 中长链脂酰辅酶A |
| 23 | Lauroyl-CoA | 月桂酰辅酶A | 6244-92-4 | HMDB0003571 | 中长链脂酰辅酶A |
| 24 | Myristoyl-CoA | 肉豆蔻酰辅酶A | 3130-72-1 | HMDB0001521 | 中长链脂酰辅酶A |
| 25 | Palmitoleoyl-CoA | 棕榈油酰辅酶A | 18198-76-0 | HMDB0006532 | 中长链脂酰辅酶A |
| 26 | Palmitoyl-CoA | 棕榈酰酰辅酶A | 1763-10-6 | HMDB0001338 | 中长链脂酰辅酶A |
| 27 | Heptadecanoyl-CoA | 十七酰辅酶A | 3546-17-6 | HMDB0006497 | 中长链脂酰辅酶A |
| 28 | Oleoyl-CoA | 油酰辅酶A | 1716-06-9 | HMDB0001322 | 中长链脂酰辅酶A |
| 29 | Stearoyl-CoA | 硬脂酰辅酶A | 362-66-3 | HMDB0001114 | 中长链脂酰辅酶A |
| 30 | Arachidonoyl-CoA | 花生四烯酰辅酶A | 17046-56-9 | HMDB0006523 | 中长链脂酰辅酶A |

部分辅酶标准品提取离子色谱图(XIC)

细胞样本实测辅酶定量参考

Acetyl-CoA标准曲线参考
Blackwell Science Ltd, The Plant Journal, (2001), 25, 115-125.
Neubauer S., Chu D.B., Marx H. et al. LC-MS/MS-based analysis of coenzyme A and short-chain acyl-coenzyme A thioesters. Anal. Bioanal. Chem., 2015, 407: 6681-6688.
丙酮酸代谢酶DLAT通过抑制亮氨酸分解代谢促进肿瘤发生
标题:丙酮酸代谢酶DLAT通过抑制亮氨酸分解代谢促进肿瘤发生
期刊:Cell Metabolism
发表时间:2025年3月
背景
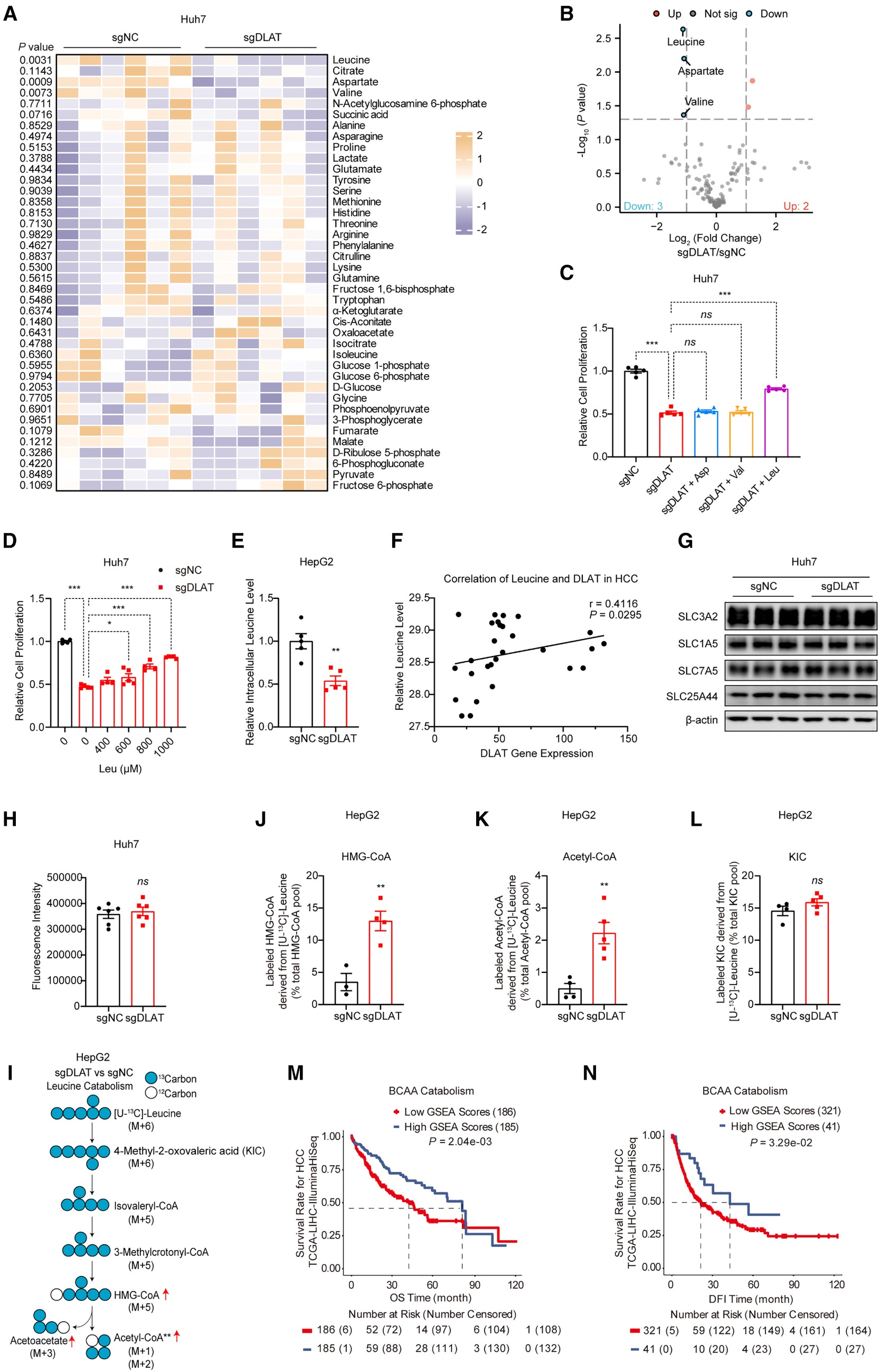
近年代谢重编程研究表明,作为 Warburg 效应核心中间体与糖酵解-三羧酸循环枢纽的丙酮酸及其代谢,在肿瘤发生发展中起关键调控作用。丙酮酸脱氢酶(PDH)复合体核心亚基 PDHE2(即乙酰转移酶 DLAT),既催化乙酰辅酶 A 生成,又可作为蛋白乙酰转移酶维持细胞存活,但它是否通过调控支链氨基酸(BCAA)代谢等途径促癌仍待阐明。BCAA 代谢在肿瘤进程中至关重要,如亮氨酸可通过激活mTORC1通路促进肝癌发展;其分解代谢中的限速酶AUH,负责催化生成 S-3-羟基-3-甲基戊二酰辅酶A(HMG-CoA),但该酶的代谢活性调控及肿瘤生物学功能尚不明确。目前丙酮酸代谢与 BCAA 分解代谢的相互作用机制仍属未知,本文借助稳定性同位素示踪代谢流技术,重点探究了两条通路的互作机制及 DLAT 的双重促癌作用。
材料与方法
该研究通过[U-13C]亮氨酸代谢流实验,检测DLAT基因敲除细胞(sgDLAT)中亮氨酸分解代谢的下游代谢产物(4-Methyl-2-oxovaleric acid,KIC和辅酶A类物质)。
结果
靶向DLAT促进HCC患者亮氨酸分解代谢:
·DLAT基因敲除导致细胞中亮氨酸、天冬氨酸和缬氨酸的水平显著降低。补充亮氨酸能够有效逆转DLAT缺失导致的细胞生长抑制
·DLAT基因敲除细胞(sgDLAT)亮氨酸分解代谢的下游产物HMG-CoA和乙酰辅酶A水平显著升高,而其上游代谢中间产物4-甲基-2-氧戊酸(4-Methyl-2-oxovaleric acid,KIC)比例保持不变,DLAT的缺失主要促进了亮氨酸脱氢后的分解步骤(即支链α-酮酸脱氢酶复合体BCKDH催化的步骤),而非其转氨过程。
VDAC2 羟基化参与通过线粒体相关铁死亡诱导的脓毒症所致心肌功能障碍
标题:VDAC2 羟基化参与通过线粒体相关铁死亡诱导的脓毒症所致心肌功能障碍
期刊:International Journal of Biological Sciences
发表时间:2023年6月
背景
脓毒症诱导心肌功能障碍(SIMD)的患者死亡率极高,其发病机制尚未完全明确,虽已知炎症反应、线粒体功能障碍等可能参与,但去甲肾上腺素等传统治疗效果有限。
蛋白质赖氨酸丙二酰化(Kmal)在炎症、2 型糖尿病及心肌肥厚中起重要作用,却未被探索在 SIMD 中的作用;丙二酰辅酶 A(malonyl-CoA)可参与代谢调节,也是蛋白质丙二酰化的关键诱导物,但它在脓毒症中如何调控心肌细胞丙二酰化、线粒体功能及铁死亡进而影响 SIMD,机制尚不明确,这是本研究核心切入点。
材料与方法
·模型构建与样本收集
建立脓毒症大鼠模型以获取心肌组织;收集 30 例脓毒症患者及 15 例健康对照者的血清样本。
·蛋白质组学与代谢组学检测
对脓毒症大鼠心肌组织开展赖氨酸丙二酰化(Kmal)蛋白质组学筛选及生物信息学富集分析,鉴定差异修饰蛋白及位点;采用 LC-MS 代谢组学技术检测大鼠心肌组织中辅酶 A 类代谢物(如丙二酰辅酶 A,malonyl-CoA)含量,同时检测临床血清样本中 malonyl-CoA 水平。
·细胞与动物干预实验
细胞:用乙酰辅酶 A 羧化酶 2(ACC2)干扰腺病毒(Ad-shACC2)转染 H9C2 细胞,或 ACC2 抑制剂(ND-630)处理细胞,检测线粒体铁离子(mito-Fe²⁺)、线粒体活性氧(mito-ROS)、丙二醛(MDA)及还原型 / 氧化型谷胱甘肽(GSH/GSSG)比值等铁死亡相关指标。
动物:在脓毒症大鼠模型中给予 ND-630 干预,观察心肌线粒体形态、功能及动物生存率等指标。
结果
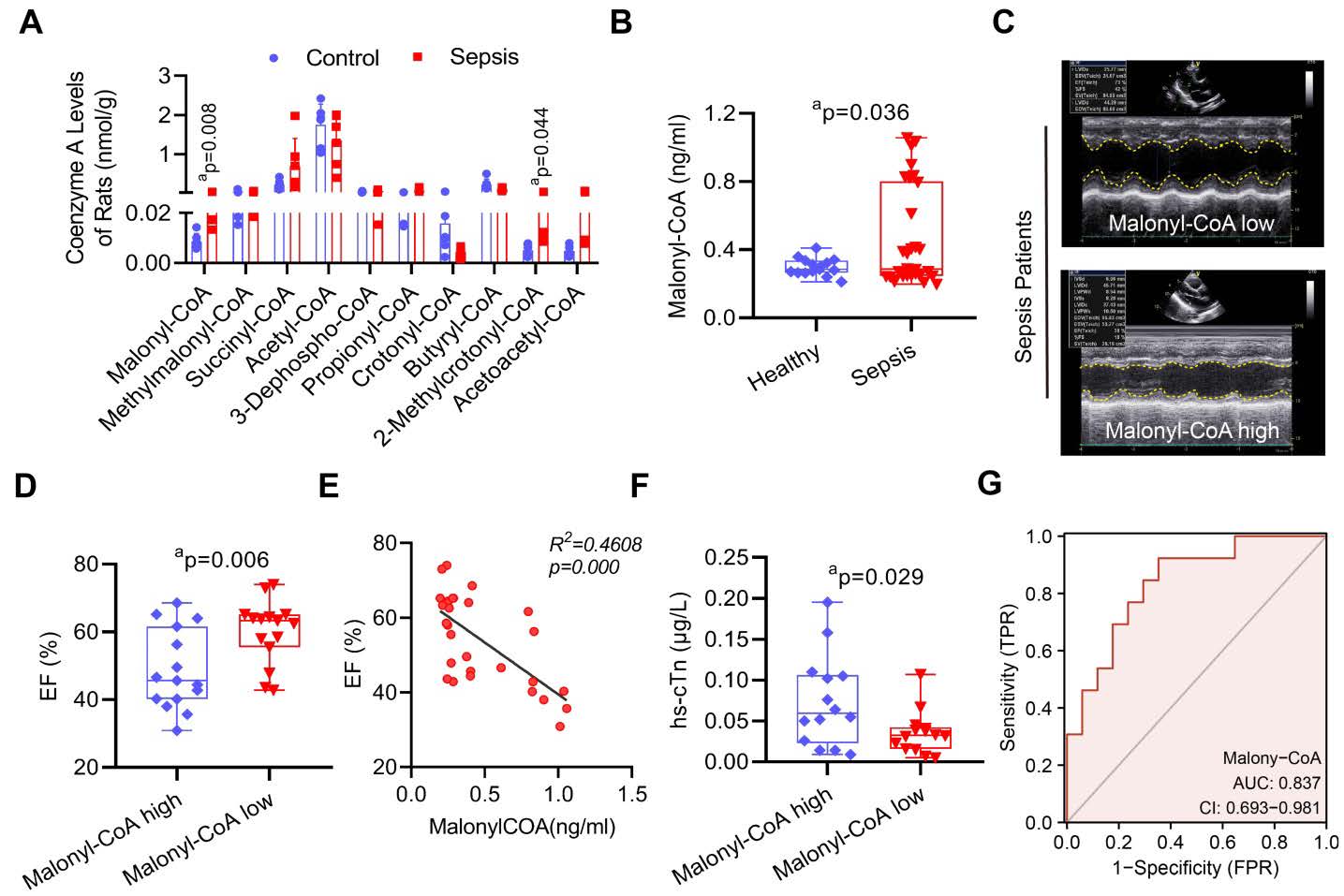
脓毒症诱导心肌功能障碍(SIMD)中存在 VDAC2 K46 位点丙二酰化修饰
·对脓毒症大鼠心脏组织的 Kmal 蛋白质组学筛选显示,差异丙二酰化修饰蛋白主要富集于铁死亡及胆固醇代谢通路;进一步鉴定发现,电压依赖性阴离子通道 2(VDAC2)的 Lys46(K46)是丙二酰化修饰位点,证实 SIMD 过程中存在 VDAC2 丙二酰化修饰。
脓毒症后 malonyl-CoA 水平升高是 VDAC2 丙二酰化的核心诱因
·LC-MS 检测显示,脓毒症大鼠心肌组织中 malonyl-CoA 及 2 - 甲基丁酰辅酶 A 水平较对照组显著升高。
·脓毒症患者血清 malonyl-CoA 水平显著高于健康对照者,提示 malonyl-CoA 升高与临床心肌损伤密切相关。
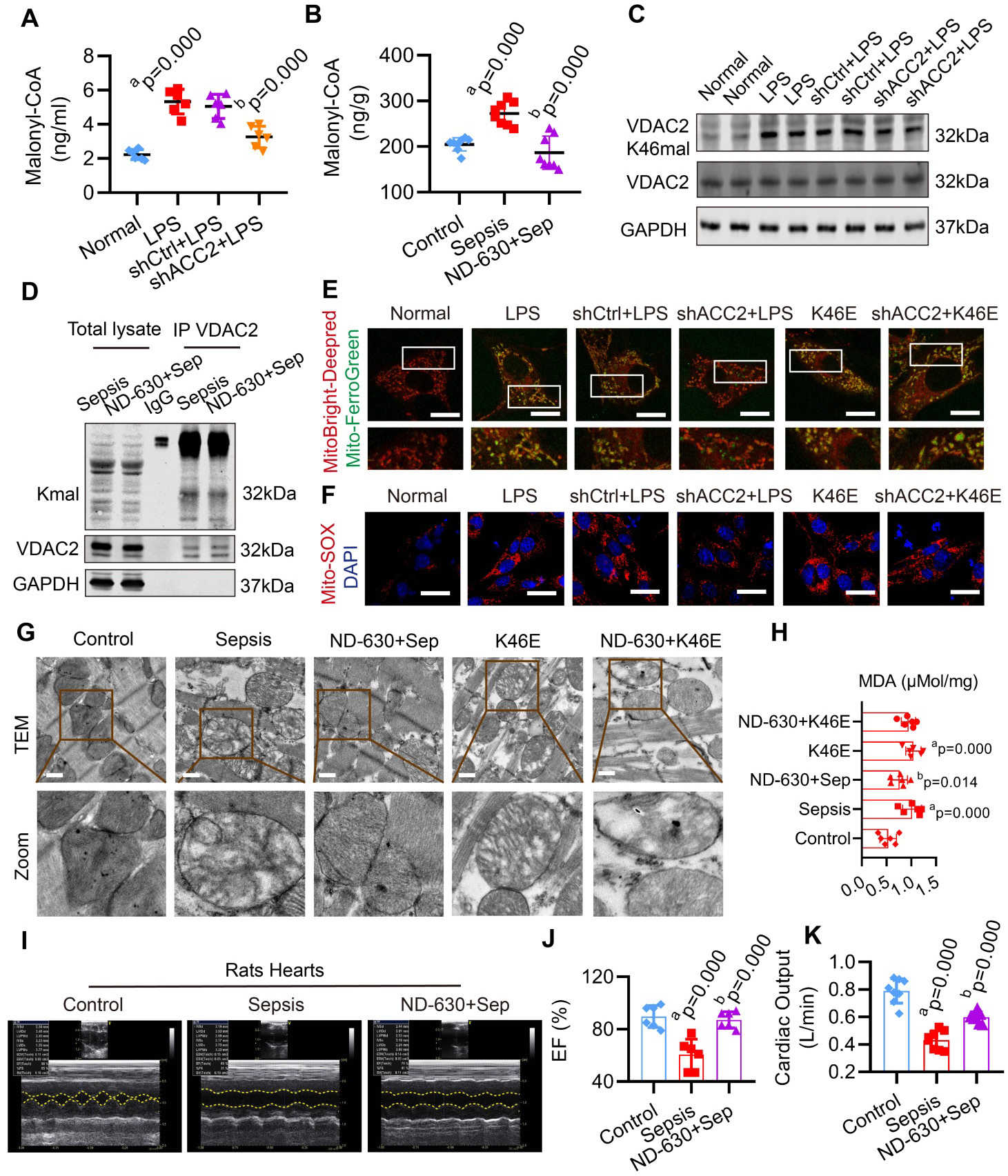
抑制 malonyl-CoA 可通过下调 VDAC2 丙二酰化,减轻 SIMD 中的线粒体相关铁死亡
·与 LPS 处理组相比,Ad-shACC2 转染可降低 H9C2 细胞的 mito-Fe²⁺、mito-ROS 及 MDA 水平,并提升 GSH/GSSG 比值,但无法完全消除 K46E(模拟丙二酰化)诱导的铁死亡。
·ACC2 抑制剂 ND-630 可改善脓毒症大鼠心肌线粒体形态、降低 MDA 水平,并通过提升左心室射血分数(LVEF)、心输出量(CO)及生存率缓解 SIMD;但该干预无法改善 K46E 过表达大鼠的线粒体损伤,提示其保护作用依赖于下调 VDAC2 丙二酰化。
参考文献
1.Wang, N. et al. Pyruvate metabolism enzyme DLAT promotes tumorigenesis by suppressing leucine catabolism. Cell Metabolism 37, 1381-1399.e9 (2025)
2.She, H. et al. VDAC2 malonylation participates in sepsis-induced myocardial dysfunction via mitochondrial-related ferroptosis. Int. J. Biol. Sci. 19, 3143–3158 (2023)





