代谢流究竟是什么?如何落地应用?谱领为您深度解析!
组学介绍
基因组学能够通过转录翻译然后对代谢物进行调控,所以说基因组会告诉我们可能发生什么;而DNA中外显子的部分会被转录到成熟的mRNA中,对中心法则下游造成影响;而转录组告诉我们什么将要发生,蛋白组告诉我们是什么驱动其发生,代谢组反应什么已经或正在发生。同时,代谢物也可以通过一些方式对DNA、RNA或蛋白进行调控,如DNA和RNA的甲基化、乙酰化等修饰,蛋白的琥珀酰化(succinate)修饰或者丙酰化(malonyl)修饰等。
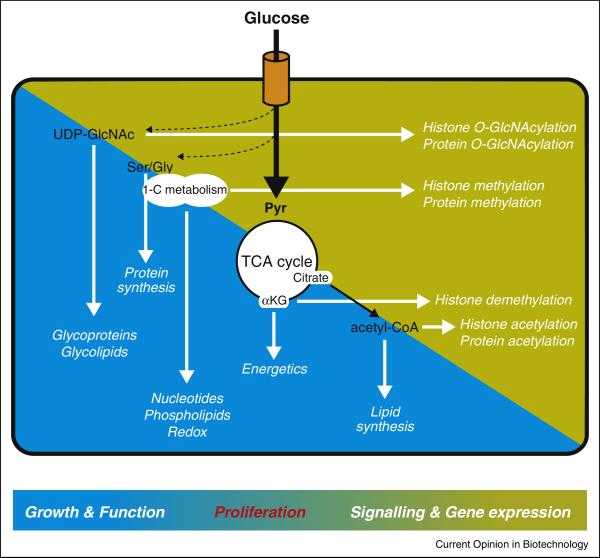
为什么需要代谢流?
研究发现,不同类型的疾病中往往存在相同的致病内源性代谢物,那相同的代谢物在不同疾病中的代谢途径存在何种差异呢,代谢组学研究的程度就无法给出明确答案。此外,代谢网络本身是高度复杂的,单一代谢物往往涉及到多条代谢通路:以丙酮酸为例,其代谢网络涵盖多条上下游通路,部分通路具有可逆性,涉及糖酵解、三羧酸循环、氨基酸合成及丁酸代谢等多个过程。仅观察到丙酮酸含量升高的时,又如何判断是上游通路代谢的增强或是下游通路消耗减少引发的堆积呢?如果我们给丙酮酸的每个原子用13C标记,就可以追踪每个碳原子在这些代谢通路中的流向,如果我在下游的代谢物中检测到13C信号时,就可以明确这部分代谢物的碳源是丙酮酸,判断其下游消耗增加还是减少。
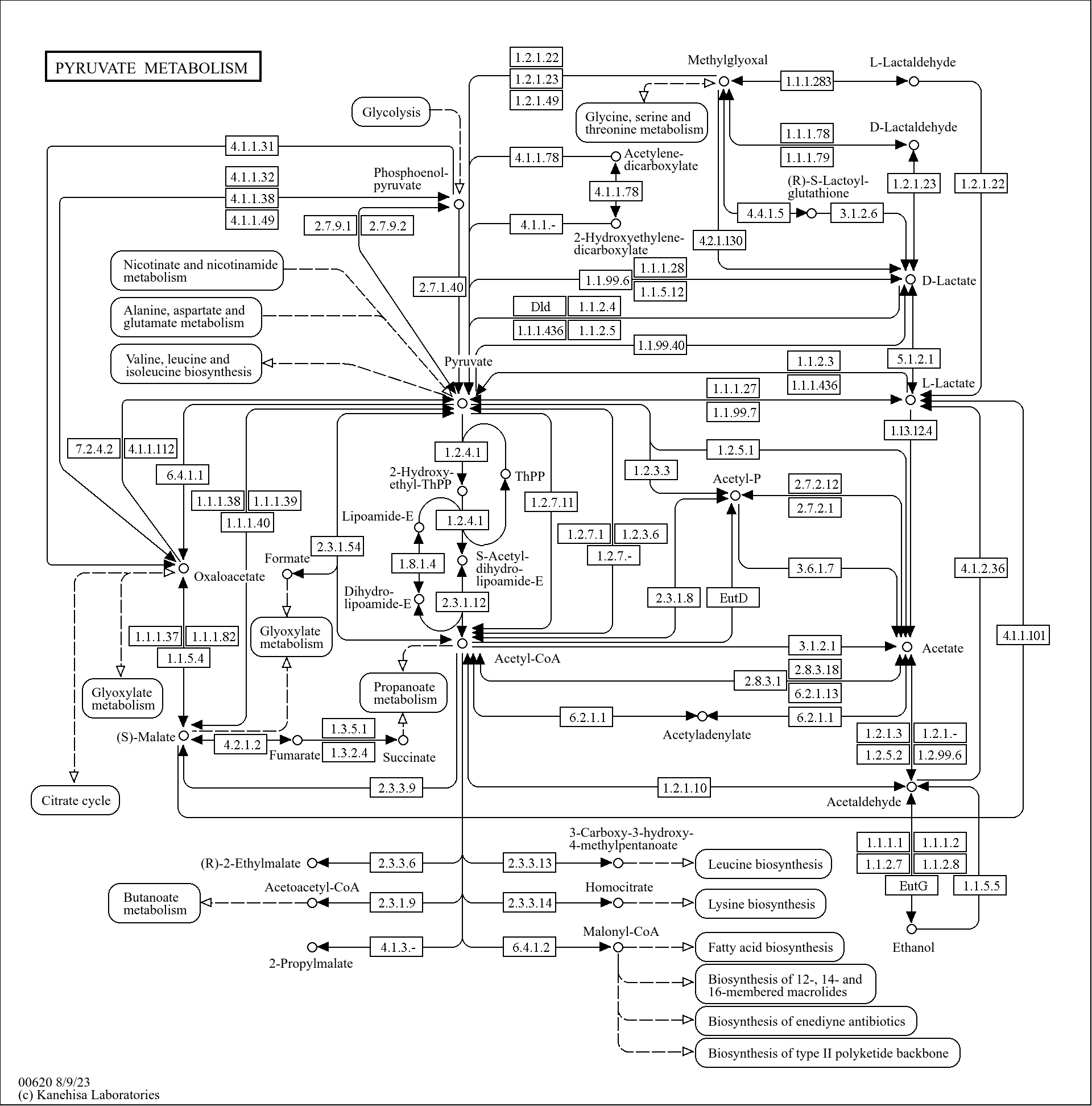
什么是代谢流?
上述用13C标记丙酮酸的技术也就是同位素标记技术(稳定同位素),代谢流(METABOLIC FLUX)即是利用稳定同位素示踪技术追踪代谢物在整个代谢反应网络中随时间变化的动态过程。
代谢流的过程:将同位素标记的物质添加到细胞(微生物)、植物或实验动物的生长介质中,实验对象会摄取并利用这些标记物质参与自身代谢。对于静态代谢通量分析,实验对象内代谢物需要一定的时间才能达到恒定的标记状态,这被称为同位素稳态,即进入与排出实验对象的同位素量不随时间变化或准稳态(在特定时间段内近似达到稳态)。此时若上游供能稳定,实验对象的代谢即可判定为稳态,其下游代谢物的同位素标记状态也会保持稳定。
在代谢流研究的通路中,最常见的就是能量代谢(图A),图B是以[U-13C]-谷氨酰胺为前体物质进行标记的代谢通路示例。在紫色通路中(谷氨酰胺还原性羧化过程),谷氨酰胺(Gln,M+5)脱氨基氧化生成α-酮戊二酸(α-KG,M+5),α-KG还原羧化生成柠檬酸(Cit,M+5),然后生成乙酰辅酶A(AcCoA,M+2)和草酰乙酸(OAA,M+3),富马酸(Fum,M+3)、苹果酸(Mal,M+3)。在红色通路中(TCA循环),谷氨酰胺(Gln,M+5)脱氨氧化生成α-酮戊二酸(α-KG,M+5),然后α-KG进入TCA,生成琥珀酸(Suc,M+4)、富马酸(Fum,M+4)、苹果酸(Mal,M+4)等有机酸;Mal又可以在苹果酸酶的作用下生成丙酮酸(Pyr,M+3),这时候进入绿色通路,然后生成草酰乙酸(OAA,M+3)。依据代谢流结果可以清晰的清楚谷氨酰胺作为核心碳氮源,在TCA循环、糖异生、脂质合成等通路中的代谢重编程,细胞对谷氨酰胺存在多维度利用。
代谢流实验简要步骤
1.实验设计:选择合适的研究对象、感兴趣的代谢通路以及合适的示踪剂。
2.同位素标记实验:用[U-13C]-glucose或者[U-15N]-glutamine等培养细胞/细菌,或者喂养/注射入动物体内,根据细胞繁殖速度以及同位素在关注的代谢途径中达到稳态的时间去定标记时间,也可以根据同位素稳态实验(设置不同的培养标记时间点)摸索最合适的培养标记时间,然后获取生物样本。
3.样本检测:使用LC-MS/GC-MS检测目标代谢物的非标记形式(M+0)和标记形式(M+n),以表征代谢物的标记状态。
4.数据分析:包括标记和非标记代谢物的原始峰面积,天然同位素校正后的峰面积数据和相对峰面积,质量同位素分布数据(MID)。
代谢流与多组学研究示例
谱领生物合作客户广州大学王雄军团队在Cell Metabolism期刊发表题为“Xylulose 5-phosphate fosters sustained antitumor activity of progenitor-like exhausted SLC35E2+ CD8+ T effector cells”的研究论文。研究表明,D-木酮糖激酶(XYLB)通过其代谢物木酮糖-5-磷酸(Xu5P)促进祖细胞样耗竭Slc35e2+ CD8+ T细胞持续性发挥抗肿瘤活性的分子机制。
本研究通过CRISPR/Cas9体内筛选证实Xylb是肿瘤转移抑制因子,其通过特异性催化D-木酮糖生成Xu5P调控CD8+ T细胞功能,补充Xu5P可逆转该现象并增强CD8+ T细胞活化、增殖及细胞毒性。研究人员通过系统发育分析、序列比对及实验结果验证,从拟南芥基因AT5G17630的同源基因中鉴定出人类SLC35E2和小鼠Slc35e2基因是哺乳动物CD8+ T细胞摄取Xu5P的必需转运蛋白,可特异性介导Xu5P内流,进而激活磷酸戊糖途径(PPP)与糖酵解通路,维持细胞的能量稳态与氧化还原平衡。
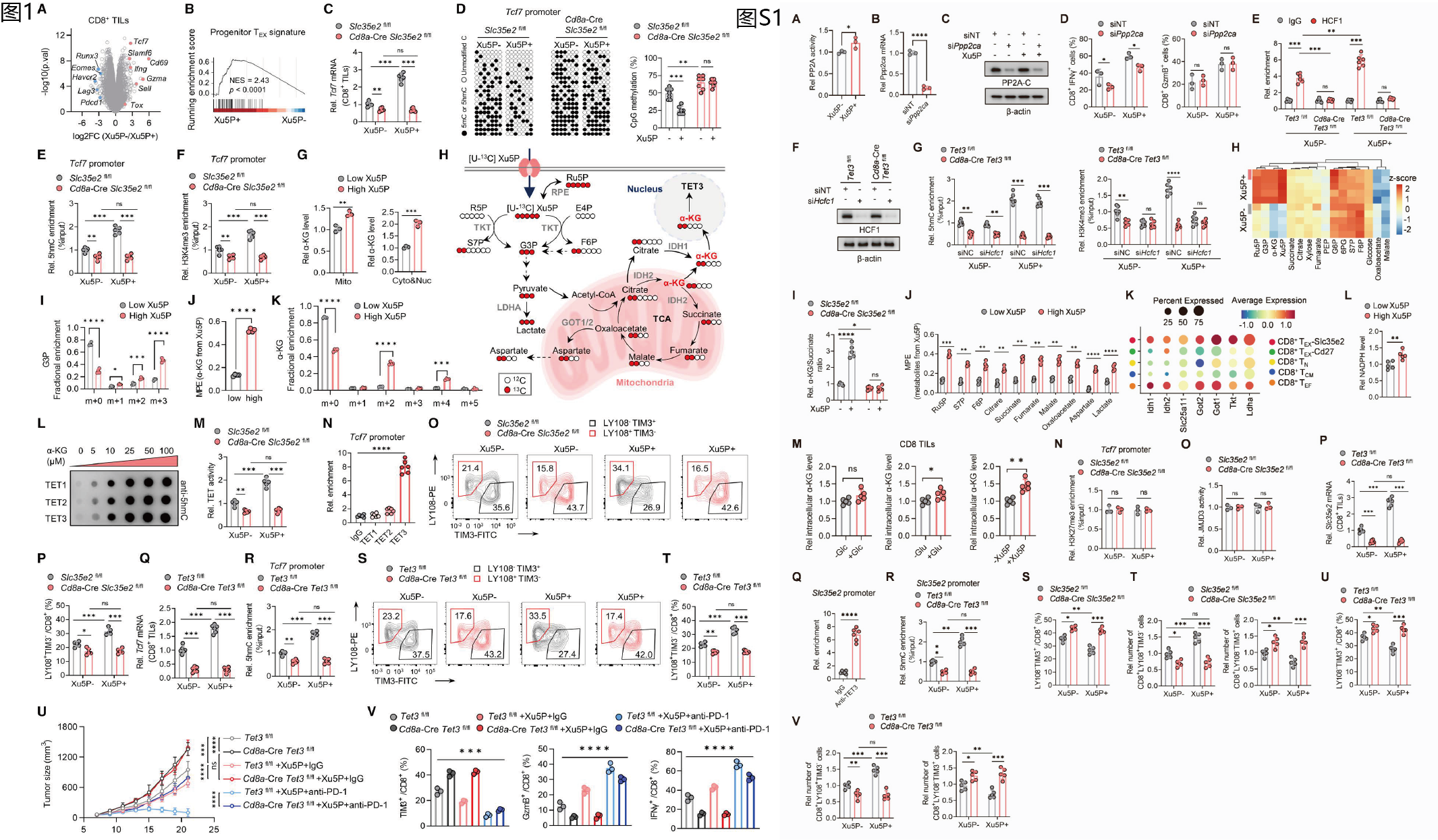
通过对祖细胞样耗竭前体T细胞(TPEX)进行转录组分析,发现Xu5P可特异性激活TPEX细胞的关键基因(尤其是Tcf7)。焦磷酸测序结果显示,在SLC35E2阳性细胞中,Xu5P 能诱导Tcf7启动子区域发生低甲基化,同时伴随5-羟甲基胞嘧啶(5hmC)水平升高及 H3K4me3富集(图1C-F)。基于上述发现,对经Xu5P处理的CD8+ TILs开展代谢组学分析,结果显示α-酮戊二酸(α-KG)、甘油醛-3-磷酸(G3P)和5-磷酸核酮糖(Ru5P)发生特异性累积(图S1H,1G)。α-KG作为TET甲基胞嘧啶双加氧酶与组蛋白去甲基化酶的必需辅因子,在表观遗传调控和干细胞命运决定中发挥关键的整合作用。
为直接评估Xu5P的代谢流向及其对α-KG生成的贡献,研究者采用[U-13C]-Xu5P对 CD8+ TILs 进行代谢流追踪实验(图1H)。结果显示,在高浓度 Xu5P 条件下,研究发现,高浓度Xu5P条件下,m+3标记的G3P积累显著增加(图1I),m+2和m+4标记α-KG水平也呈现显著升高(图1K),且超过50%的α-KG源自Xu5P代谢(图1J)。通过对PPP途径及三羧酸循环(TCA循环)相关代谢物的MPE分析,进一步证实Xu5P已整合到CD8+ TILs的代谢网络中(图S1J)。值得关注的是,Xu5P处理呈现出独特的代谢偏好:1)相较于柠檬酸,α-KG优先积累;2)草酰乙酸水平轻微下降。尤为重要的是,与等浓度葡萄糖或谷氨酰胺相比,向培养基中添加Xu5P可显著提升CD8+ TILs内的α-KG水平,这进一步证实Xu5P在促进CD8+ TILs中α-KG积累方面具有独特优势(图S1M)。后续研究证实,TET3缺失会显著削弱Xu5P调控CD8+ T细胞抗肿瘤应答的能力(图1V)。Xu5P通过SLC35E2进入细胞后,其代谢产生的α-KG以非经典来源的形式激活TET3,进而驱动Tcf7启动子去甲基化,维持细胞的祖细胞样状态,最终增强抗肿瘤效应。
本研究以[U-13C]标记Xu5P的代谢流分析为核心,与转录组学、表观组学(焦磷酸测序)、代谢组学构建“功能表型-基因表达-表观调控-代谢溯源”的闭环联合分析体系:转录组明确Xu5P可通过激活Tcf7等关键基因,重塑CD8+ T细胞的祖细胞样状态;表观组进一步验证,该基因重塑源于Tcf7启动子区域的低甲基化修饰;代谢组检测到α-酮戊二酸(α-KG)等代谢物特异性累积;代谢流分析则证实,Xu5P代谢可生成α-KG(超50%的α-KG源于Xu5P),且能整合入CD8+肿瘤浸润T细胞(CD8+TILs)的磷酸戊糖途径(PPP)、糖酵解及三羧酸循环(TCA循环)等核心代谢网络。而α-KG作为TET甲基胞嘧啶双加氧酶与组蛋白去甲基化酶的必需辅因子,能够激活TET3,进而驱动Tcf7启动子去甲基化,维持CD8+ T细胞的祖细胞样状态。代谢流分析作为贯穿全程的关键纽带,突破了其他组学仅能揭示关联性的局限,不仅验证了SLC35E2介导Xu5P转运的有效性,量化了Xu5P作为α-KG非经典来源的核心贡献,还证实其与细胞核心代谢网络的整合性,最终完整闭合“Xu5P→SLC35E2转运→代谢生成α-KG→激活TET3→Tcf7启动子去甲基化→维持祖细胞样状态→增强CD8+ T细胞抗肿瘤活性”的调控环路。
谱领生物
上海谱领生物专注于高端代谢组和基于稳定性同位素示踪的代谢流等技术研发和服务,是国家级研发项目承担单位。谱领拥有齐全的高质量技术平台体系、庞大的自建内源性化合物标准品色谱质谱数据库、数百种稳定性同位素化合物内标。持续的技术革新和产品迭代,以及快速研发能力,为您的高质量研究保驾护航。




