Cell Metab: 木酮糖5-磷酸竟然促进祖细胞样耗竭SLC35E2+ CD8+ T效应细胞的持续抗肿瘤活性
2025年7月17日,谱领生物合作客户广州大学王雄军团队在著名期刊Cell Metabolism期刊发表题为“Xylulose 5-phosphate fosters sustained antitumor activity of progenitor-like exhausted SLC35E2+ CD8+ T effector cells”的研究论文。研究表明,D-木酮糖激酶(XYLB)通过其代谢物木酮糖-5-磷酸(Xu5P)促进祖细胞样耗竭Slc35e2+ CD8+ T细胞持续性发挥抗肿瘤活性的分子机制。

中文题目:木酮糖5-磷酸竟然促进祖细胞样耗竭SLC35E2+ CD8+ T效应细胞的持续抗肿瘤活性
杂志:Cell Metabolism (IF: 27.7)
合作单位:广州大学
谱领提供服务:糖酵解、三羧酸循环和戊糖磷酸途径代谢流,尤其是3种戊糖磷酸同分异构体的检测
01. 研究背景
肿瘤转移是导致患者死亡的主要原因。CD8+T细胞作为抗肿瘤免疫的关键效应细胞,其识别和清除肿瘤细胞的功能与代谢重编程密切相关,但是尚未阐明。然而,转移性癌细胞极强的代谢活性和适应性,使得靶向其代谢途径异常困难。因此,探索参与肿瘤转移和免疫逃逸的代谢适应机制至关重要。值得注意的是,D-木酮糖激酶(XYLB)催化生成的木酮糖-5-磷酸(Xu5P)是连接磷酸戊糖途径(PPP)非氧化分支与糖酵解的关键节点。已有研究表明,木酮糖途径(GX)是细胞内Xu5P的主要来源,具有调控代谢稳态的重要生物医学意义。然而,Xu5P如何满足CD8+ T细胞抗肿瘤反应的代谢需求尚不清楚。本研究采用多种分子生物学技术包括基于稳定性同位素示踪的代谢流分析技术,揭示Xu5P调控CD8+ T细胞功能、维持抗癌免疫应答的分子机制,并探索基于此机制的转移性癌症潜在治疗策略。
02. 研究内容及结果
1. 木酮糖激酶(XYLB)通过促进CD8+ T细胞的应答能力发挥肿瘤转移抑制作用
CRISPR/Cas9体内筛选结果显示,靶向Xylb基因的sgRNA序列在免疫功能正常小鼠的转移病灶中显著富集,提示XYLB是转移抑制因子。与此结果一致,在免疫正常小鼠中XYLB敲低(shXylb)的Renca细胞不仅表现出生长优势,还显著增加肺转移负荷。此外,免疫细胞清除实验(如CD8+T细胞、CD4 T细胞、自然杀伤细胞和巨噬细胞)结合流式细胞和免疫荧光染色结果显示,shXylb肿瘤中的CD8+T细胞浸润减少,瘤细胞凋亡受到抑制。哺乳动物只有XYLB特异性催化D-木酮糖生成Xu5P。Xu5P含量测试结果显示XYLB敲低细胞内、肿瘤间质液(TIF)和肿瘤小鼠血液中的Xu5P水平均显著降低。功能研究结果表明,OT-I CD8+ T细胞和Renca-GFP-OVA细胞的共培养显示XYLB敲低的肿瘤细胞逃避了T细胞介导的杀伤,然而此免疫逃逸可以通过XYLB重新引入或补充Xu5P逆转,恢复CD8+ T细胞中干扰素-γ(IFNγ)和肿瘤坏死因子α(TNF-α)的产生。体外Xu5P处理可上调初始小鼠CD8+ T细胞的活化和增殖标志物(Ki-67、IFNγ、TNF-α)的表达。体内静脉注射Xu5P能够升高血液Xu5P浓度,增强CD44+和CD8+细胞活化,减少小鼠淋巴结中TIM-3+耗竭CD8+ T细胞,并增加IFNγ+/TNF-α+CD8+ T细胞。在转移模型中,Xu5P治疗展现出显著抗肿瘤效果:在EO771肺转移模型和原位自发转移模型中,Xu5P增加了肺转移灶中CD8+ T细胞的比例和数量,减少了肺转移结节的数量,并增强了CD8+ T细胞的细胞毒性。
XYLB通过调控Xu5P生成影响CD8+ T细胞功能,进而抑制肺转移,肿瘤细胞释放或外源补充Xu5P可有效增强CD8+ T细胞活性和抗肿瘤反应性。
2. CD8+ T细胞SLC35E2蛋白是转运Xu5P所必需的
哺乳动物种尚未报道Xu5P转运蛋白生物存在,鉴于拟南芥基因AT5G17630可以编码木酮糖-磷酸转位器(XPI)蛋白的功能,研究人员通过系统发育分析和序列对发现了AT5G17630的人类同源基因SLC35E2(又称SLC35E2B)和小鼠Slc35e2基因。对两个癌症数据集(GEO:GSE207493和GEO:GSE156632)的单细胞RNA测序(scRNA-seq)数据进行分析发现在12种细胞群体中,T细胞中SLC35E2的表达最高。将T细胞进一步细分为四个亚群,CD8+ T细胞比其他亚群的SLC35E2表达水平明显更高。免疫荧光定位实验证实SLC35E2在CD8+ T细胞膜上存在部分分布;肿瘤浸润CD8+ T细胞中糖酵解途径关键酶(HK1/2/3)和磷酸戊糖途径酶(G6PD和PGD)基因表达升高,表明其细胞内代谢通路被激活。
对分离的鼠/人CD8+ T细胞转染siSlc35e2/SLC35E2后,外源添加Xu5P并不能升高SLC35E2缺失细胞内的Xu5P水平。作为连接戊糖磷酸途径(PPP)和糖酵解的关键代谢枢纽,Xu5P进入PPP的非氧化分支后生成果糖6-磷酸(F6P)和甘油醛3-磷酸(G3P),从而为糖酵解和三羧酸循环(TCA循环)提供代谢底物。进一步敲低下游转酮醇酶(TKT)则完全阻断了Xu5P对CD8+ T细胞功能的增强作用,表明Xu5P对CD8+ T细胞促效作用依赖于其进入由TKT催化的下游代谢途径。SLC35E2敲低后,Xu5P无法增强CD8+ T细胞的活化标志物、细胞毒性及关键代谢指标(NAD+/NADH、ATP、乳酸、耗氧率OCR、细胞外酸化速率ECAR),这些结果确证SLC35E2是哺乳动物CD8+ T细胞中Xu5P的特异性转运蛋白。
作者建立CD8+ T细胞条件敲除小鼠(Cd8a-Cre Slc35e2fl/fl),将MC38细胞注射到Slc35e2fl/fl和Cd8a Cre-Slc35e2fl/fl小鼠体内,结果显示Slc35e2敲除后肿瘤生长加速,表明CD8+ T细胞抗肿瘤功能受损;OT-I+转移模型中,即使补充外源Xu5P,Slc35e2缺失的OT-I+ CD8+ T细胞向肿瘤的迁移能力、IFN-γ/TNF-α分泌以及杀伤功能(诱导肿瘤凋亡)均显著减弱,最终导致肿瘤转移增强。
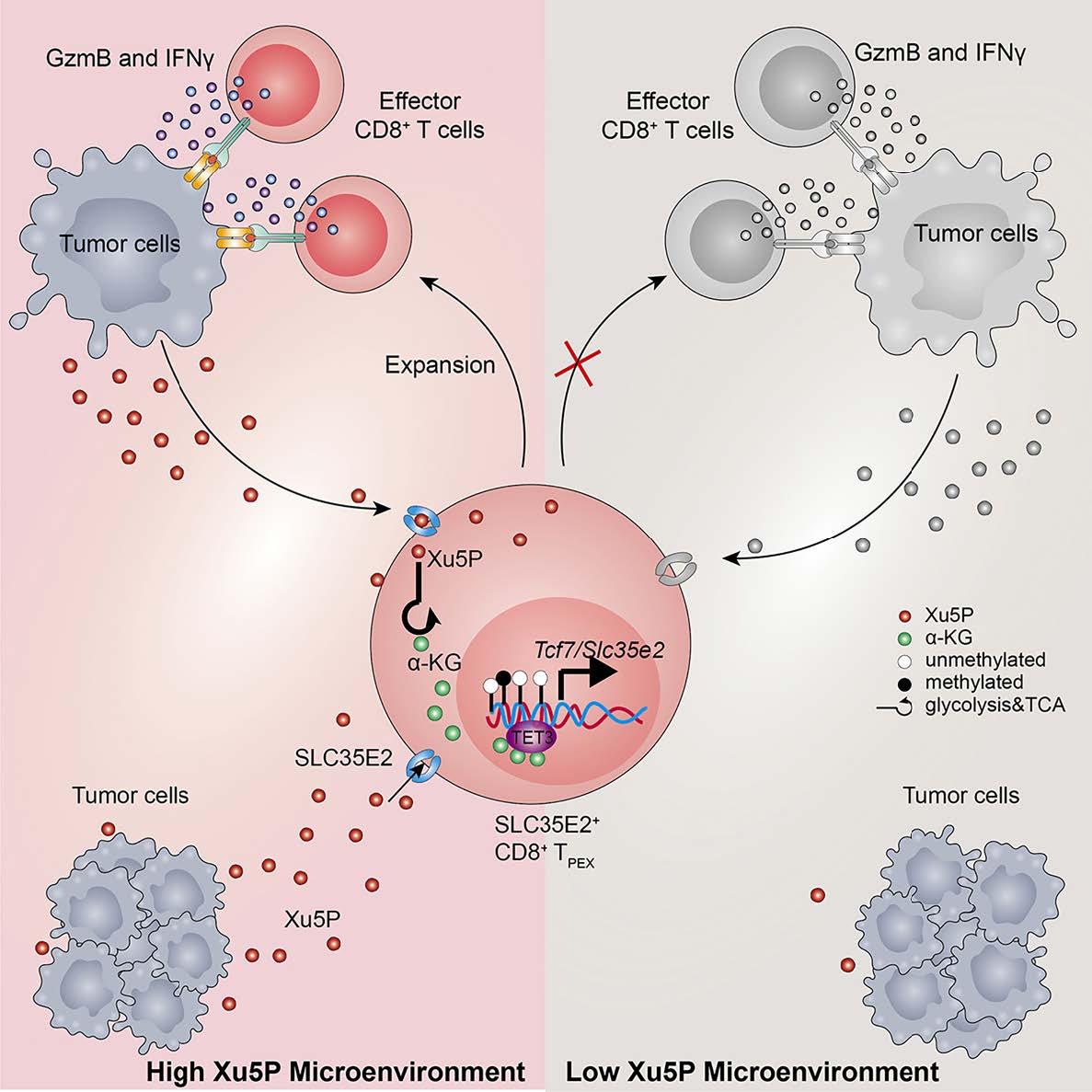
SLC35E2被鉴定为CD8+ T细胞特异性转运木酮糖-5-磷酸(Xu5P)的必需转运蛋白,其敲低阻断Xu5P摄取并减弱CD8+ T细胞功能和抗肿瘤免疫。
3. 肿瘤浸润淋巴细胞Xu5P反应祖细胞样SLC35E2+ CD8+细胞群的鉴定
本研究从肿瘤浸润淋巴细胞(TILs)中鉴定出一类Xu5P响应性SLC35E2+ CD8+ T细胞亚群,该群体具有祖细胞样特性。Xu5P处理显著扩增CD8+ T细胞群,转录组分析进一步证实其特异性富集祖细胞样耗竭T细胞(TPEX;LY108+ TIM-3+)以及SLC35E2+耗竭性CD8+ T细胞(TEX-Slc35e2)。通过特异性扩增肿瘤微环境中的TPEX细胞,Xu5P驱动SLC35E2+ PD-1+ CD8+ T细胞在转移灶(尤其肺转移)中显著聚集,改善肾癌患者预后,且该效应与转移灶中XYLB表达呈强正相关。
在肿瘤浸润CD8+ T细胞中发现了一群对Xu5P响应的,具有祖细胞样特性的SLC35E2+亚群,Xu5P能特异性扩增该群体并在转移灶富集,与患者良好预后及转移灶XYLB表达正相关
4. Xu5P通过TET3介导的Tcf7启动子DNA去甲基化维持祖细胞样CD8+ TEX-Slc35e2细胞,从而增强CD8+ T细胞反应
研究表明,Xu5P虽可增强肝细胞中蛋白磷酸酶2A(PP2A)活性,但PP2A敲低并不影响Xu5P对CD8+ T细胞中IFNγ和GZMB表达的上调作用(图1SA-D),提示其免疫调节机制独立于PP2A通路。转录组分析进一步揭示,Xu5P特异性激活祖细胞样耗竭前体T细胞(TPEX)关键基因(尤其是Tcf7),同时抑制终末耗竭T细胞(TTEX)相关基因(图1A-B)。在SLC35E2阳性细胞中,Xu5P诱导Tcf7启动子区域发生显著表观遗传重塑:焦磷酸测序证实低甲基化状态,伴随5-羟甲基胞嘧啶(5hmC)水平升高及H3K4me3富集(图1C-F)。
α-酮戊二酸(α-KG)作为TET甲基胞嘧啶双加氧酶催化的DNA羟甲基化以及组蛋白去甲基化酶的辅因子,在表观遗传调控和干细胞命运决定中发挥关键整合作用。对Xu5P处理的CD8+肿瘤浸润T细胞(CD8+ TILs)进行代谢组学分析显示,α-酮戊二酸(α-KG)、甘油醛-3-磷酸(G3P)和5-磷酸核酮糖(Ru5P)特异性累积(图S1H),且α-KG/琥珀酸比值升高依赖于SLC35E2表达(图S1I)。亚细胞分级实验证实Xu5P诱导的α-KG在细胞质和细胞核中积累(图1G)。
为直接评估Xu5P代谢流及其对α-KG生成的贡献,研究者们采用[U-13C]标记的Xu5P对CD8+肿瘤浸润T细胞(TILs)进行代谢流标记实验(图1H)。研究发现,高浓度Xu5P条件下,m+3标记的3-磷酸甘油醛(G3P)积累显著增加(图1I),m+2和m+4标记α-KG水平也呈现显著升高(图1K),且超过50%的α-KG(摩尔百分比富集度MPE= 0.523)源自Xu5P代谢(图1J)。通过对磷酸戊糖途径(PPP)和三羧酸循环(TCA循环)相关代谢物的MPE分析,进一步证实Xu5P被整合至CD8+ TILs代谢网络中(图S1J)。
值得注意的是,Xu5P处理表现出独特的代谢偏好:1)相较于柠檬酸,α-KG优先积累;2)草酰乙酸轻微减少。对CD8+ T细胞不同亚群(如耗竭前体细胞PEX和效应细胞EF)中Idh1/2、Got1/2等相关基因进行分析(图S1K),结果显示这些代谢反应在CD8+ TPEX和CD8+ TEF中活性较高,与既往报道一致。高浓度Xu5P可提升CD8+ TILs中NADPH水平,可能通过Xu5P诱导的糖酵解供能来缓冲氧化还原平衡(图S1L)。特别值得注意的是,与等浓度葡萄糖或谷氨酰胺相比,培养基中添加Xu5P显著提高了CD8+ TILs内α-KG水平(图S1M),进一步证明Xu5P在促进CD8+ TILs中α-KG积累方面具有独特优势。
TET3条件性敲除(Cd8a-Cre Tet3fl/fl)完全阻断了Xu5P的表观遗传效应:TET3缺陷细胞中既未出现5hmC升高(图1Q,R),也未观察到TPEX/TTEX比例改变(图1S,T)。体内实验进一步证实,在Tet3fl/fl和Cd8a-Cre Tet3fl/fl荷瘤小鼠体内实验中,TET3缺失显著削弱了Xu5P的抗肿瘤作用和PD-1协同效应(图1U)。对CD8+ TILs中耗竭标志物TIM3、细胞毒性因子IFNγ和颗粒酶GzmB的表达分析进一步证实,TET3缺失会显著损害Xu5P调控CD8+ T细胞抗肿瘤应答的能力(图1V)。
Xu5P通过SLC35E2进入细胞后,其代谢产生的α-KG作为非经典来源激活TET3,驱动Tcf7启动子去甲基化以维持祖细胞样状态,该表观遗传机制是其增强CD8+T细胞抗肿瘤功能的核心。

图1.Xu5P通过Tcf7启动子介导的DNA去甲基化维持祖细胞样CD8+ TEX-Slc35e2细胞,从而增强CD8+ T细胞的反应

图S1. Xu5P通过Tcf7启动子介导的DNA去甲基化维持祖细胞样CD8+ TEX-Slc35e2细胞,从而增强CD8+ T细胞反应
5. Xu5P 增强免疫检查点阻断治疗在体内的反应性
临床分析显示,血液中高XYLB水平的肾癌患者总生存期更长。相反,肿瘤XYLB低表达且血液Xu5P水平低的患者转移风险显著升高,且血液Xu5P浓度与肿瘤XYLB表达呈正相关。在转移性患者中,高血液Xu5P水平与更好的生存预后相关,并伴随其CD8+ T细胞耗竭标志物(PD-1, TIM3, LAG3)减少及活化标志物CD137增加。动物实验中,αPD-1抗体与Xu5P联合治疗展现出协同抗肿瘤效应:联合组显著增强了肺肿瘤浸润淋巴细胞(TILs)中CD8+ T细胞的活化、减少耗竭标志物表达、并提升细胞毒性效应分子水平。相应地,联合治疗组CD8+ T细胞的NAD+/NADH比值和ATP含量也显著升高,并显著延长荷瘤小鼠生存期。鉴于植物性食物(如苦瓜、百合)中Xu5P含量高于动物产品,补充一周苦瓜或百合饮食可有效提升小鼠血浆Xu5P水平。在Renca-Luc肺癌和EO771乳腺癌转移模型中,该饮食干预显著改善小鼠生存率。此外,体外Xu5P预处理可显著增强CAR-T细胞的肿瘤细胞清除能力。
临床和临床前研究表明,Xu5P水平与患者良好预后相关,且Xu5P能协同增强PD-1阻断治疗的抗肿瘤效果,富含Xu5P的饮食或体外预处理也能提升治疗效果。
03. 研究结论
1. 通过体内代谢基因CRISPR/Cas9筛选,首次明确XYLB作为肿瘤抑制因子,其代谢物Xu5P通过增强CD8+ T细胞毒性抑制肿瘤肺定植。
2. CD8+ T细胞高表达SLC35E2转运蛋白(植物Xu5P转运体同源物),特异性介导Xu5P内流,进而激活磷酸戊糖途径(PPP)与糖酵解,维持细胞能量/氧化还原稳态。
3. Xu5P通过TET3介导的Tcf7启动子去甲基化,驱动SLC35E2+祖细胞样耗竭T细胞(TPEX) 扩增,增强CD8+ T细胞持久抗肿瘤应答。
4. 小鼠模型中,Xu5P补充(注射或富Xu5P饮食)与抗PD-1疗法显著协同,增强抗肿瘤免疫力,提示膳食干预可作为转移性癌症的辅助治疗策略。
谱领生物
代谢流是连接基因和表型的重要桥梁,其能够通过定量描绘代谢物在复杂网络中的实时流动,揭示代谢重编程的本质,为发现新的治疗靶点、阐明耐药机制等提供强大的技术支持和理论依据。
如果您的研究涉及代谢领域,可以添加下方谱领代谢售前服务咨询!





