Cell Metab: 甲硫氨酸代谢流助力发现新型抗炎因子Homocysitaconate!
01 文章信息

标题:Homocysitaconate controls inflammation through reshaping methionine metabolism and N-homocysteinylation
期刊:Cell Metabolism
online:2025.8.27
影响因子:27.7
02 研究背景
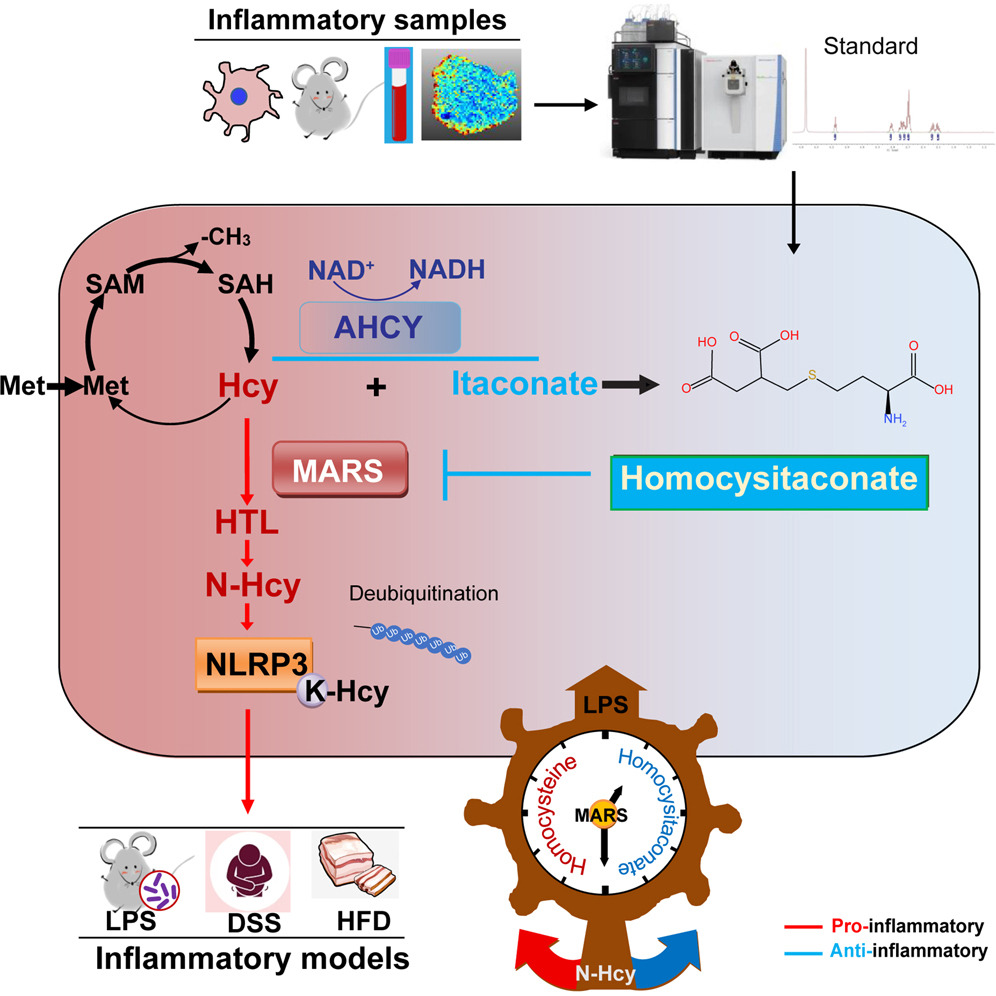
免疫代谢学这一新兴领域正为炎症调控与干预策略带来全新视角。已有研究显示,衣康酸(itaconate,ITA)作为巨噬细胞抗炎反应的关键代谢物,理论上能够与多种含巯基(-SH)的代谢物发生反应,然而,除“衣康酰-CoA”外,其他反应产物仍属未知,其生物学功能更有待揭示。更具矛盾性的是,同型半胱氨酸(homocysteine,Hcy)本身具有促炎效应,但合成它的腺苷同型半胱氨酸酶(AHCY)却同时表现出促炎与抗炎的双重角色。另一方面,甲硫氨酰-tRNA合成酶(MARS)不仅能结合Hcy,还可介导蛋白质发生“N-高半胱氨酸化(N-Hcy)”修饰。然而,MARS是否直接参与炎症调控,目前仍是一个未解之谜。本研究揭示了一种全新的抗炎物质Homocysitaconate(Hci),并系统阐释了Hci通过重塑甲硫氨酸代谢和调控N-Hcy,进而控制炎症的作用机制。
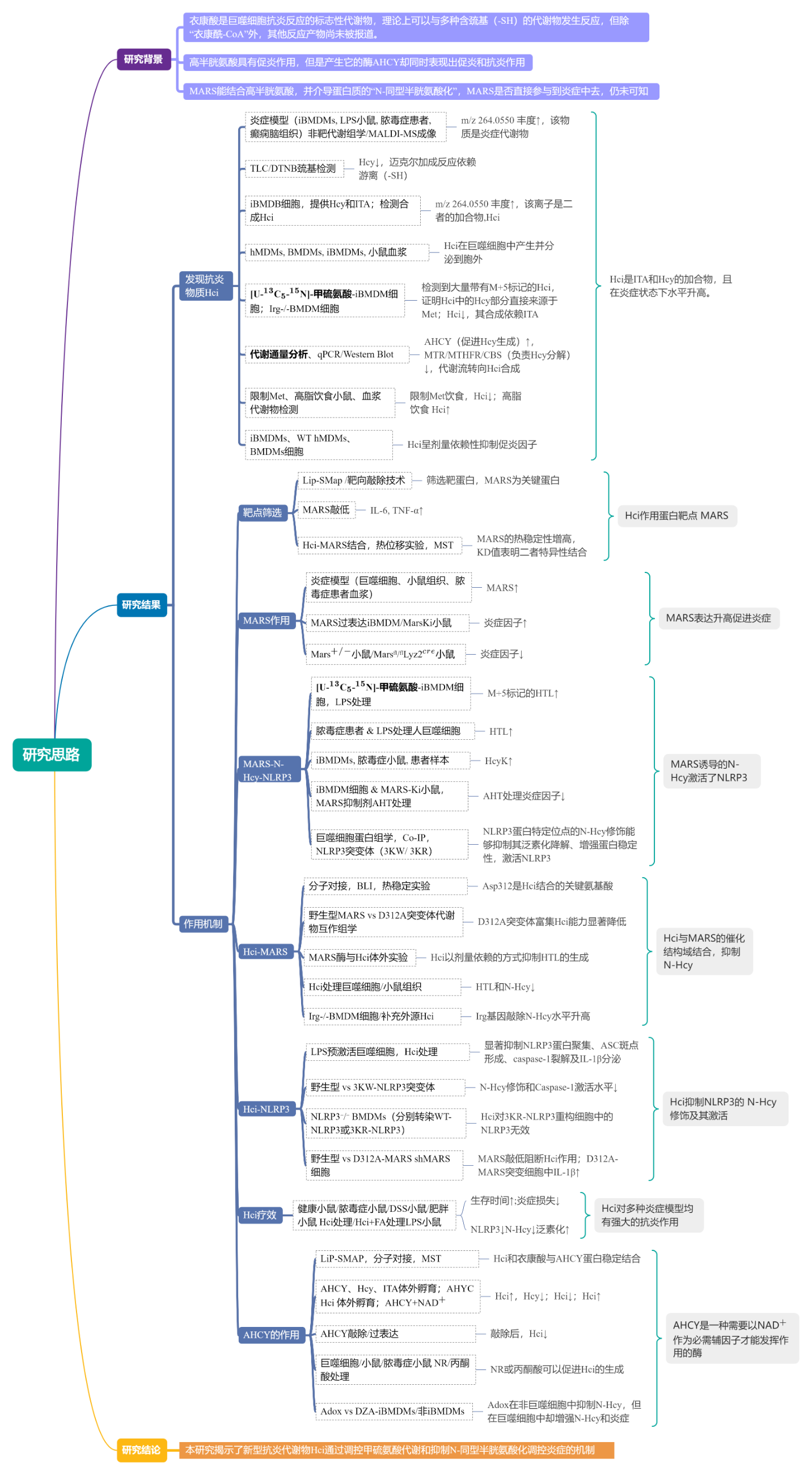
03 研究思路
04 研究内容及结果
1. Hci是ITA和Hcy的加合物,且在炎症状态下水平升高
通过永生化骨髓来源巨噬细胞iBMDMs的非靶代谢组学数据鉴定出m/z 264.0550是ITA和Hcy的加合物——Homocysitaconate(Hci)。稳定同位素[U-13C5-15N]-甲硫氨酸示踪实验结果显示Hci来源于甲硫氨酸,进一步的代谢流分析表明,LPS作用下Hcy从再甲基化和转硫途径中分流,转向Hci合成。同时研究表明限制甲硫氨酸饮食会降低血浆中Hci的水平,高脂饮食则相反。为了探究Hci的功能,对Hci处理的iBMSMs(LPS预激活)细胞进行了RNAseq检测物并进行了GO分析,结果显示促炎性细胞因子基因表达减少,而抗炎性白细胞介素-10(IL-10)水平升高。Hci剂量依赖性抑制iBMDMs、hMDMs、BMDMs细胞中的促炎因子水平,且抑制糖酵解,与ITA抗炎作用机制不同,不依赖于KEAP1-NRF2通路。接着在动物实验中,Hci能够降低脓毒症模型小鼠的炎症水平,Hcy与ITA联合处理具有良好的抗炎作用。
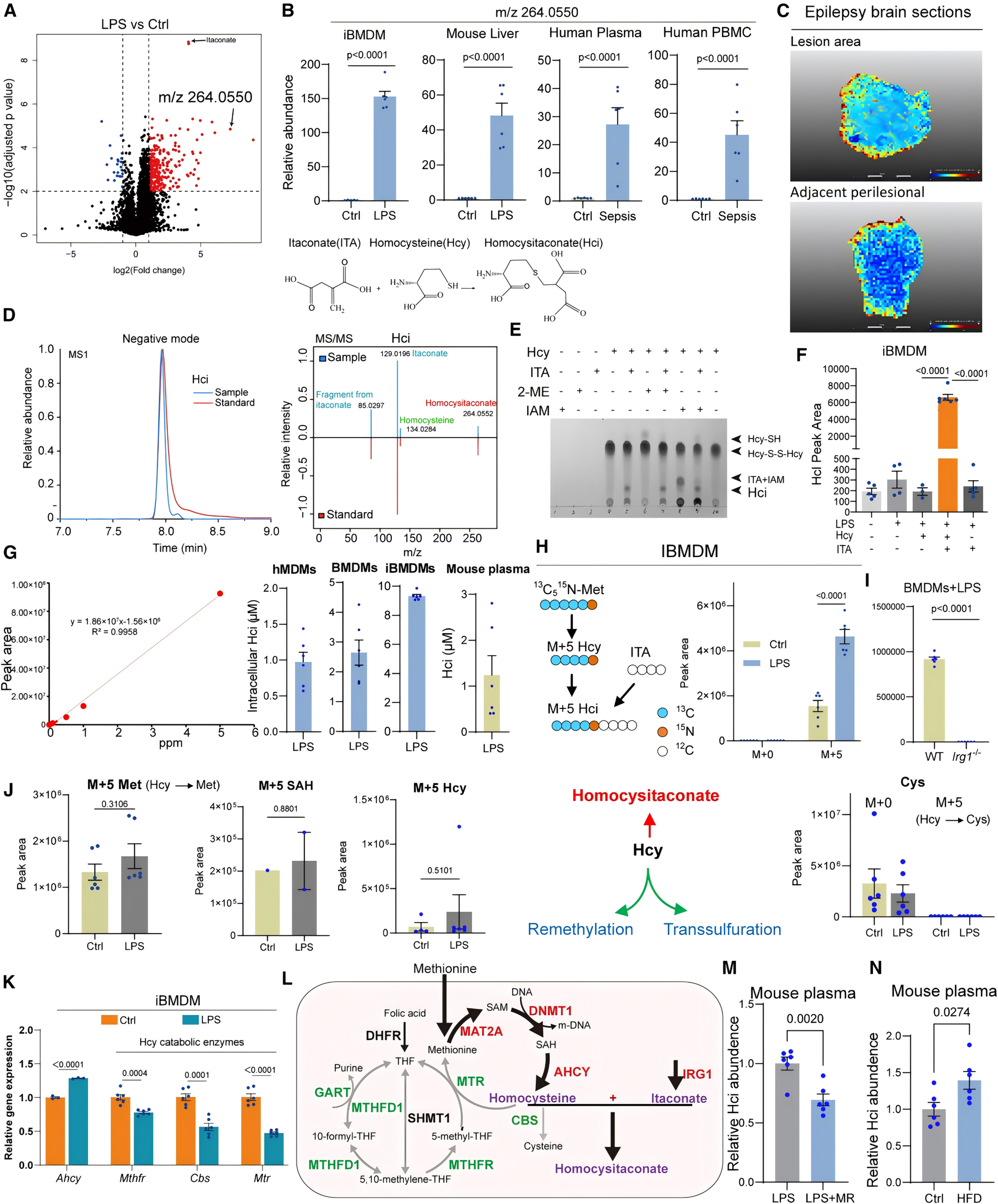
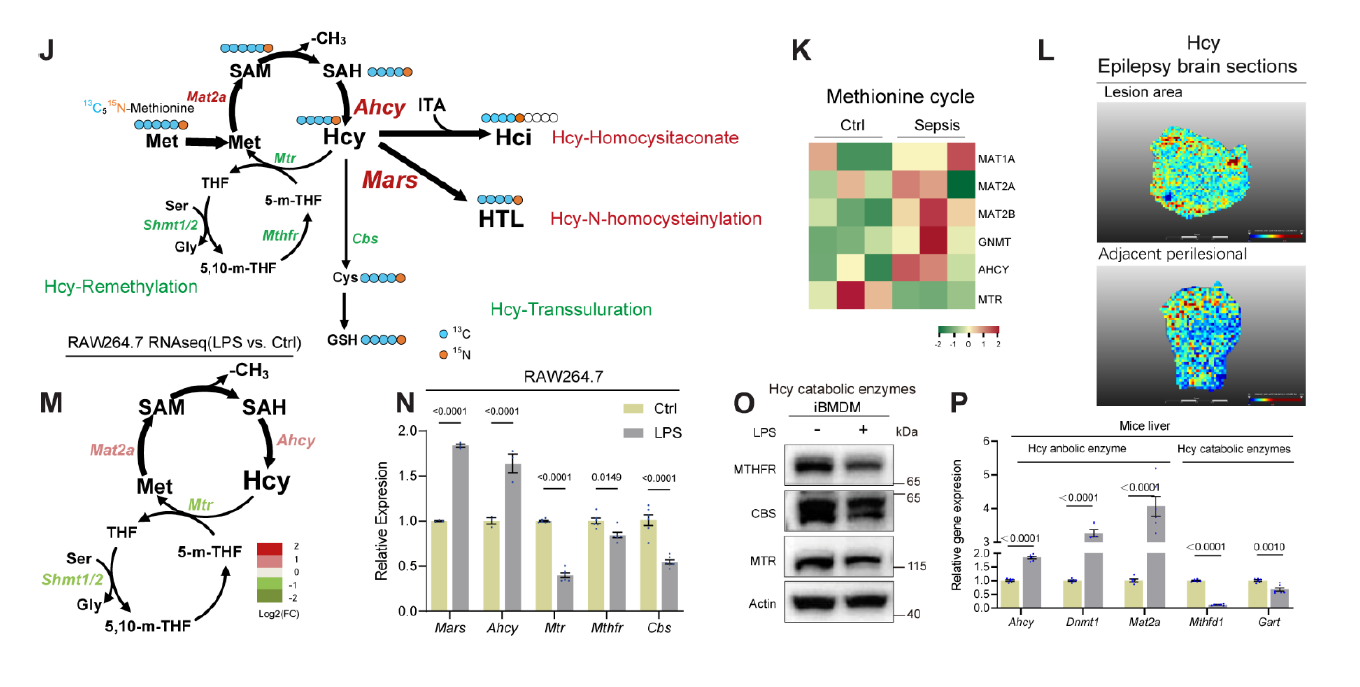
图1 将炎症反应代谢物m/z264.0550鉴定为衣康酸(ITA)和同型半胱氨酸(Hcy)的加合物
2. 利用Lip-SMAP鉴定潜在的Hci靶点
为探究Hci的抗炎机制,首先利用Lip-SMAP技术筛选Hci作用的蛋白靶点16个,并通过靶向敲除技术验证甲硫氨酸-tRNA合成酶(MARS)基因敲除会消除Hci的抑制促炎因子的作用,MARS不仅是炎症调节因子也是Hci的作用靶点,热稳定性分析和微量热泳动证实Hci与MARS结合的稳定性。巨噬细胞、小鼠组织、脓毒症患者血浆中MARS水平显著升高,在MARS过表达的iBMDMs的细胞和MARS敲入(Mars-Ki)小鼠中,LPS刺激后细胞因子水平升高,相反,在敲除MARS基因(Mars+-)小鼠和髓系特异性Mars缺失(MarsLyz2 )小鼠中炎症反应降低,以上均证明了MARS的促炎作用。
3.MARS诱导的N-Hcy激活了NLRP3
为追踪MARS在炎症中诱导的代谢变化,将iBMDMs与[U-13C5-15N]-甲硫氨酸共培养,LPS处理后显著增加了M+5同型半胱氨酸硫内酯(HTL),表明MARS将Met-Hcy代谢通路重新导向HTL合成,证明LPS诱导的MARS过表达能促进HTL生成,与脓毒症患者及LPS处理的人源巨噬细胞中HTL水平升高的现象一致,HTL能够修饰蛋白质中的赖氨酸残基形成N-Hcy,通过蛋白组学研究发现,巨噬细胞激活的关键调控因子NLRP3在K194、K338和K339位点发生了N-Hcy修饰,并构建了NLRP3突变体(3KW/3KR)进行验证,修饰位点则抑制了泛素化降解、增强蛋白稳定性,从而驱动NLRP3的组装和激活。
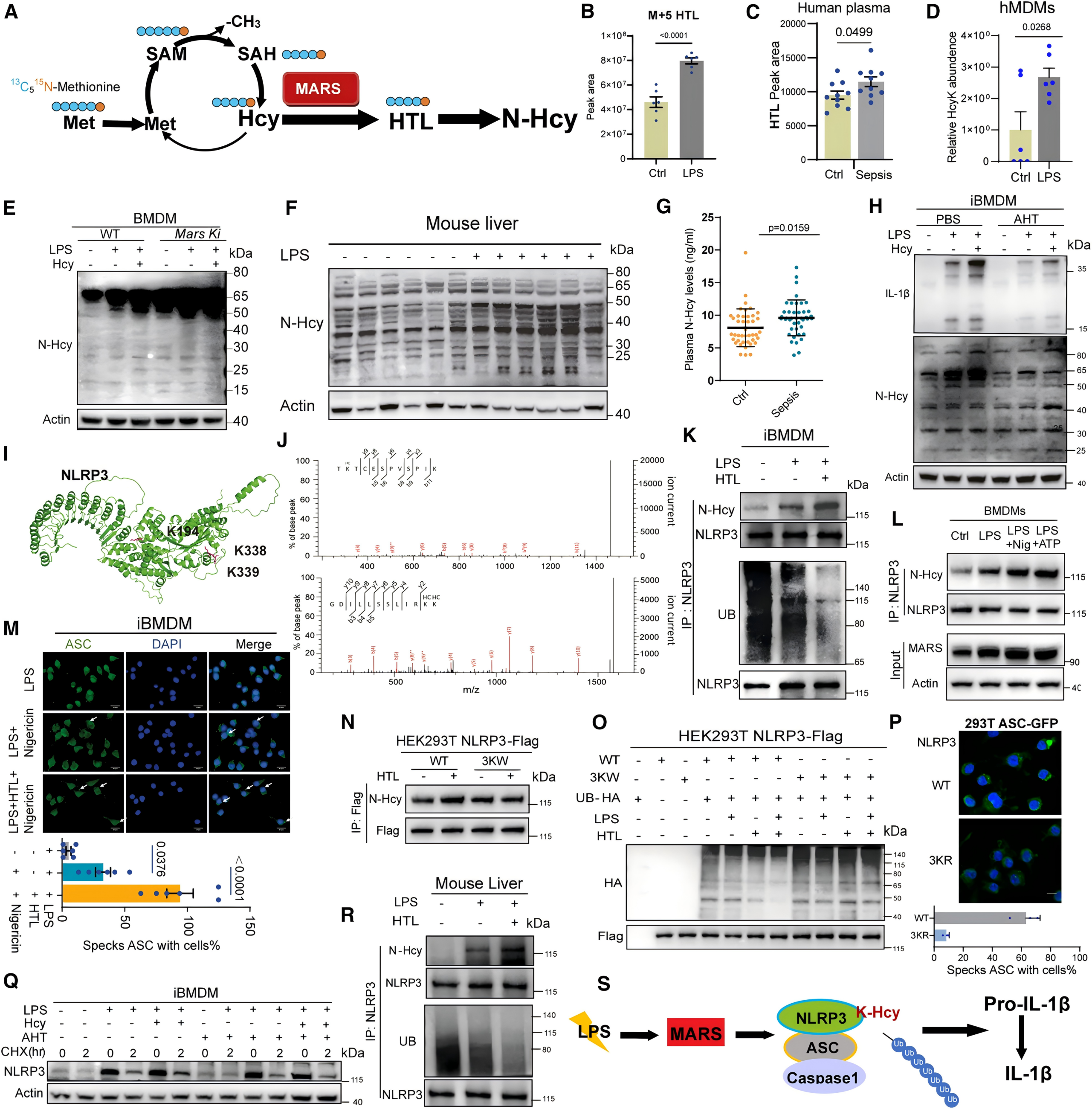 图2 在炎症状态下,MARS过表达驱动甲硫氨酸转化为HTL,以支持NLRP3的N-Hcy及其激活
图2 在炎症状态下,MARS过表达驱动甲硫氨酸转化为HTL,以支持NLRP3的N-Hcy及其激活
4.Hci与MARS的催化结构域结合,抑制N-Hcy
MARS具有独特的结构域,Lip-SMAP数据和分子对接预测Hci通过CAT结构域中的天冬氨酸312(Asp312)、亮氨酸272(Leu272)和酪氨酸274(Tyr274)残基与MARS结合,生物层干涉法和热稳定性实验证明在Hci与MARS的结合中,D312A突变体作用消失,Asp312是关键结合位点。MARS与Hci体外实验结果表明,Hci以剂量依赖的方式抑制HTL的生成。Hci处理降低了巨噬细胞和小鼠组织中的HTL、HcyK及N-Hcy水平,Irg-/-BMDM细胞N-Hcy水平升高,补充外源Hci则逆转此现象。MARS抑制剂AHT减弱了Hci对N-Hcy和细胞因子的影响,证实Hci通过抑制MARS并减少N-Hcy来发挥抗炎作用。
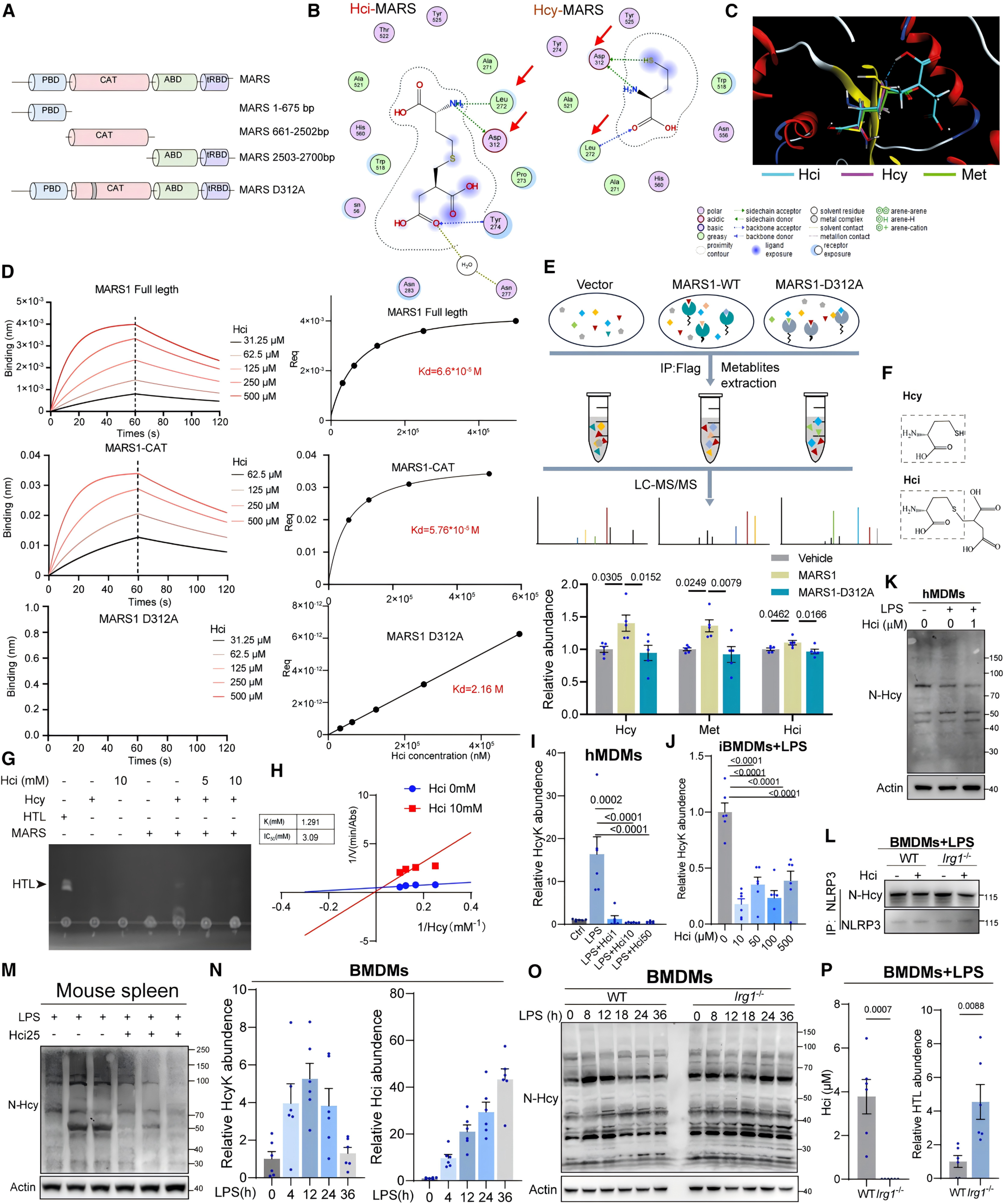 图3 Hci是MARS的底物类似物抑制剂,可抑制N-Hcy
图3 Hci是MARS的底物类似物抑制剂,可抑制N-Hcy
5.Hci抑制NLRP3的N-Hcy修饰及其激活
NLRP3炎症小体的激活分为起始和激活两个阶段。研究发现,Hci不影响Nlrp3、Pycard等炎症小体相关基因的转录,但在LPS预激活后、尼日利亚菌素刺激前给予Hci可显著抑制NLRP3积累、ASC斑点形成、caspase-1切割及IL-1β分泌,从而阻断NLRP3炎症小体的激活。Hci通过抑制NLRP3的N-Hcy(依赖K194/K338/K339位点),促进NLRP3泛素化降解;对N-Hcy酰化位点突变体(3KW-NLRP3)或上述赖氨酸位点突变体(3KR-NLRP3)则无作用。此外,Irg1敲除会减少内源性Hci,导致NLRP3的N-Hcy及caspase-1 p20水平升高,补充该物质可逆转此效应。该抑制作用还依赖MARS,敲低或抑制MARS会阻断其效果;且高半胱氨酸衣康酸仅能抑制野生型MARS(WT-MARS)表达细胞的IL-1β分泌,对MARS的D312位点突变体(D312A-MARS)细胞无影响,提示其通过靶向MARS的D312位点发挥作用。
6.Hci对多种炎症模型均有强大的抗炎作用
Hci对多种炎症模型均表现出强大的抗炎作用和治疗效果。在LPS诱导的脓毒症模型中,Hci治疗显著延长小鼠生存时间、减轻多器官的炎症损伤和病理变化,降低脾脏NLRP3的N-Hcy并增强其泛素化,这种效应在DSS诱导的结肠炎小鼠模型和高脂饮食喂养的肥胖小鼠模型中均存在。
7.AHCY是一种依赖NAD+的Hci催化酶
通过LiP-SMAP数据,分子对接和MST实验证实了AHCY与Hci、ITA的强结合,AHCY、Hcy、ITA体外酶孵育实验显著提高了Hci的产生,AHCY与Hci孵育则会导致其降解,AHCY与NAD+孵育Hci水平显著提高,AHCY活性依赖NAD+,补充NAD+前体烟酰胺核糖或丙酮酸可提升Hci水平,降低NLRP3的N-同型半胱氨酸化,延长败血症小鼠存活。
05 研究结论
本研究发现了一种新型抗炎代谢物——Homocysitaconate,该物质通过AHCY催化、NAD+依赖性反应由Hcy与ITA结合形成。多组学分析表明,Hci通过结合MARS蛋白抑制炎症反应,揭示了MARS在免疫调节中此前未被认知的作用机制。此外,我们发现NLRP3的N-Hcy受Hci-MARS轴调控,该轴协调调控NLRP3降解与炎症小体活化。Hci水平受AHCY动态调节以响应代谢和炎症信号,而MARS则作为连接衣康酸与同型半胱氨酸代谢的传感器,共同维持炎症稳态。