Cell Metab:肠道与睡眠的 “跨器官对话”!代谢组学揭示:特定氨基酸借代谢节律,远程调控大脑睡眠
01 文章导读
生物钟是一种内在时序系统,让地球上几乎所有生物得以生存。在分子层面,昼夜节律的产生主要依赖自我维持的转录-翻译反馈环路。中枢视交叉山核(SCN) 时钟、外周时钟与睡眠稳态机制共同参与睡眠 - 觉醒周期的调控,但其具体调控机制尚未明确。肠道是重要的节律器官,其中的肠上皮细胞(IEC)生物钟在外周生物钟中居于核心地位 —— 它不仅调控肠道局部功能,还能通过传递日间进食与代谢信号,影响肝脏等外周器官的节律性代谢。鉴于昼夜节律失调与肠道疾病、睡眠障碍的关联,以及肠道生物钟在全身节律调控中的核心作用,2025年11月17日,来自广州中医药大学吴宝剑、陈敏团队在Cell Metabolism上发表了题为Intestinal clock shapes sleep-wake cycle via sustaining glutamine homeostasis的研究文章。本研究旨在探究肠道生物钟在 “与大脑神经元活动及睡眠行为的日间调控相关的代谢稳态” 中所扮演的关键角色。
02 研究方法
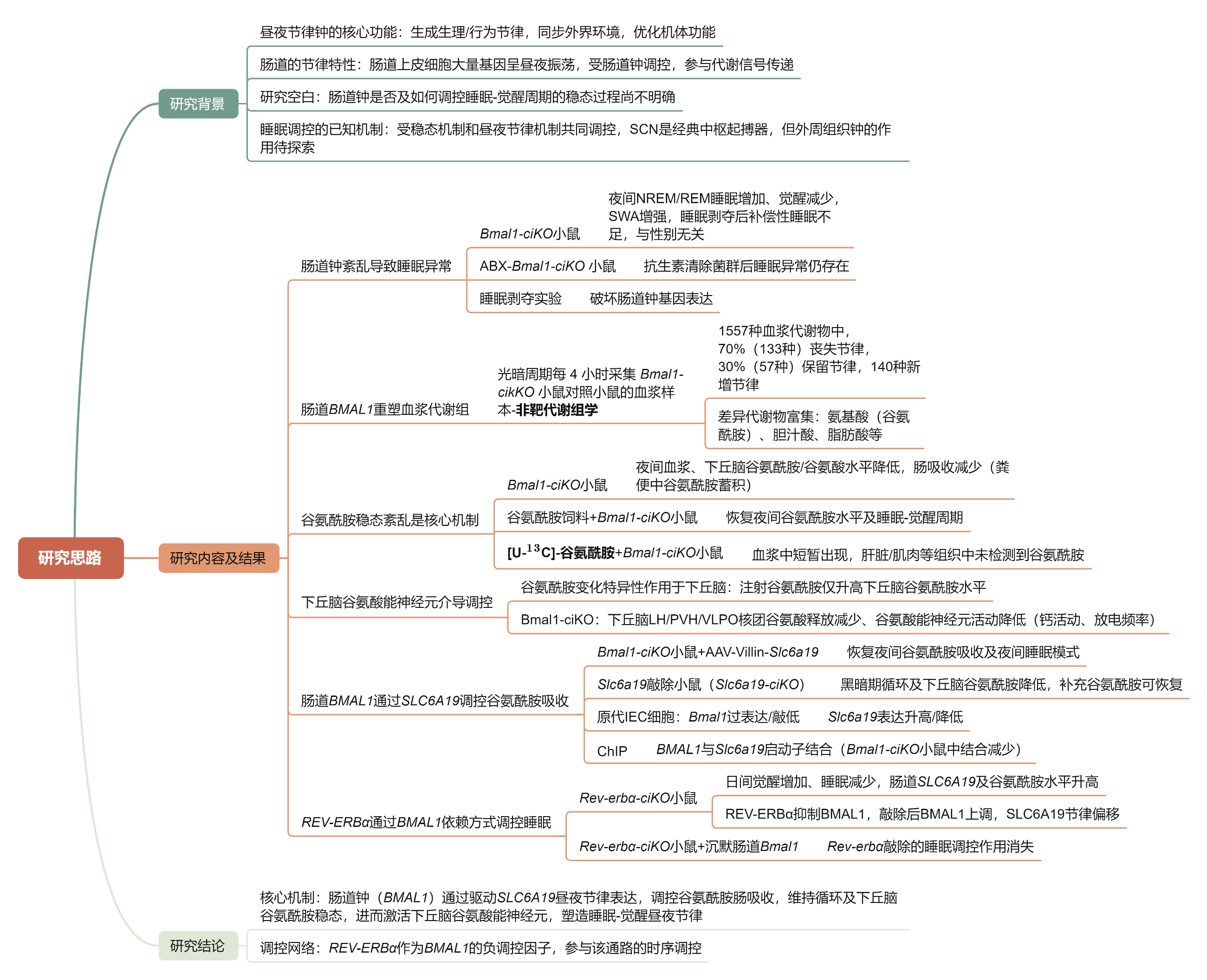
03 研究内容及结果
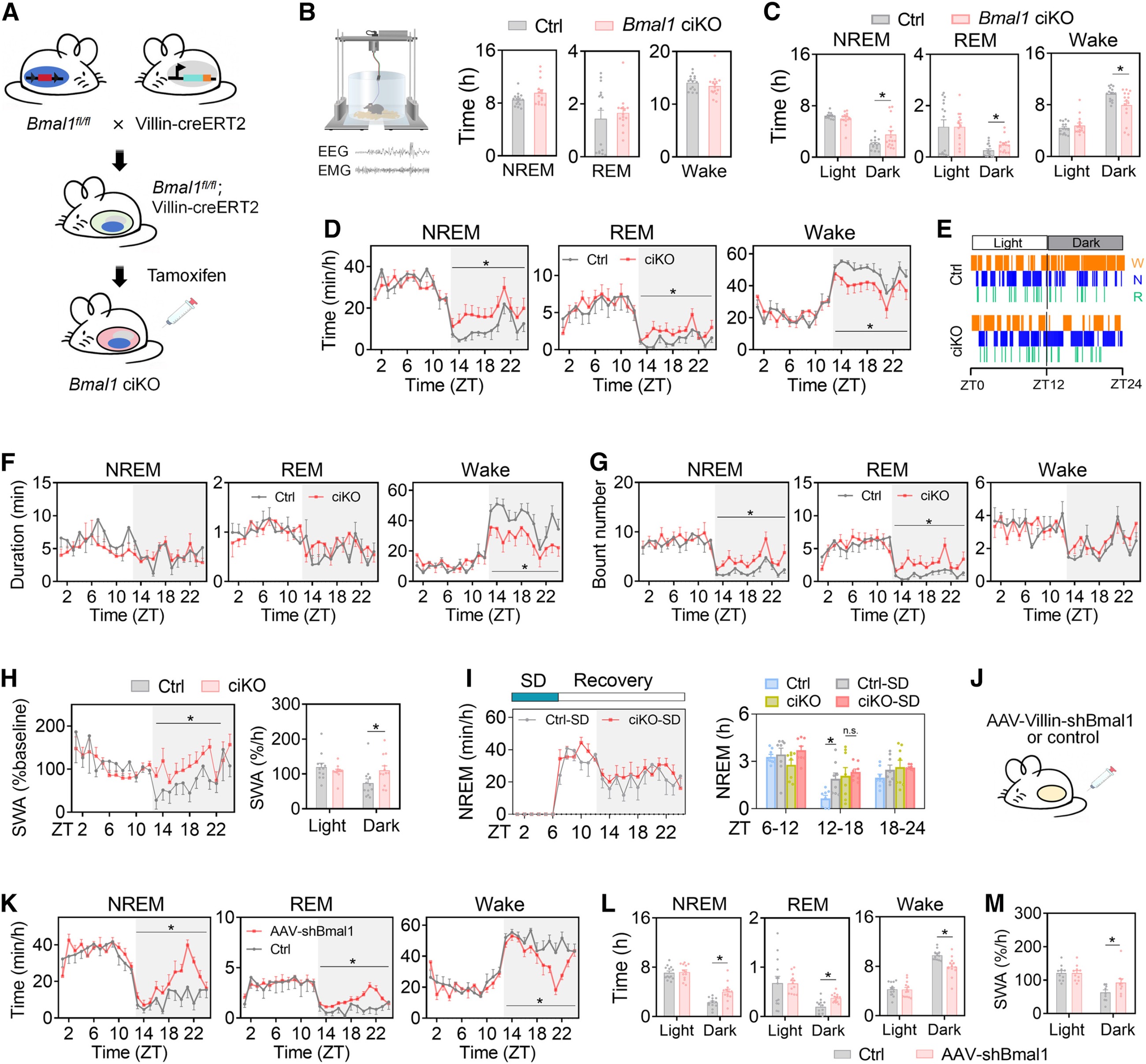
1. 肠道生物钟紊乱可引发睡眠异常,且该效应不依赖肠道微生物组
为探究肠道生物钟在睡眠-觉醒调控中的作用,研究人员构建了肠道特异性敲除Bmal1的Bmal1-ciKO小鼠模型及野生型小鼠肠道Bmal1沉默模型,这类模型小鼠的总睡眠与觉醒时长虽无变化,但睡眠-觉醒的昼夜分布出现明显紊乱:夜间非快速眼动(NREM)及快速眼动(REM)睡眠时长增加、觉醒时长缩短,同时慢波活动的节律也发生了改变,且抗生素清除肠道菌群后并未改善其睡眠节律;同时睡眠剥夺会扰乱小鼠肠道生物钟,也会引发睡眠-觉醒模式紊乱。
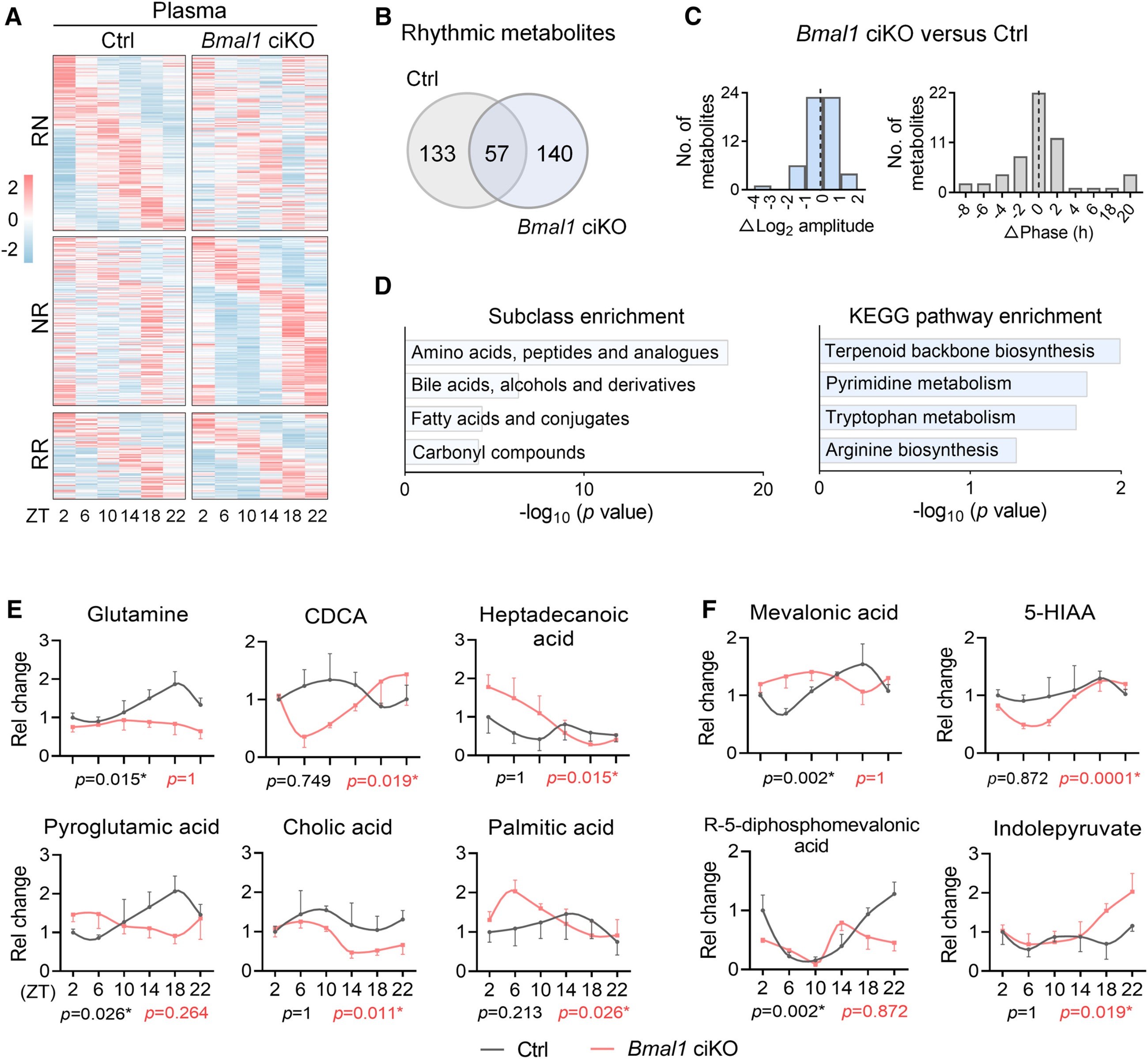
2. 肠道Bmal1可显著重塑日间血浆代谢组
鉴于近年研究表明,肠道生物钟能够调控肠道对葡萄糖、脂肪酸等营养物质的日间加工节律,研究假设肠道生物钟参与循环代谢物的昼夜波动及水平维持;通过对 Bmal1-ciKO 小鼠与对照小鼠光暗周期内每4小时采集的血浆进行代谢组学分析(共检测 1557 种代谢物),发现70%的节律代谢物失节律、30%保留节律,另有140种原本非节律的代谢物新增节律,受影响的代谢物涉及氨基酸、胆汁酸、脂肪酸等类别,富集于萜类骨架合成、嘧啶代谢、色氨酸代谢等关键通路(如谷氨酰胺、甲羟戊酸、5 -羟吲哚乙酸等节律性发生改变的典型代谢物)。
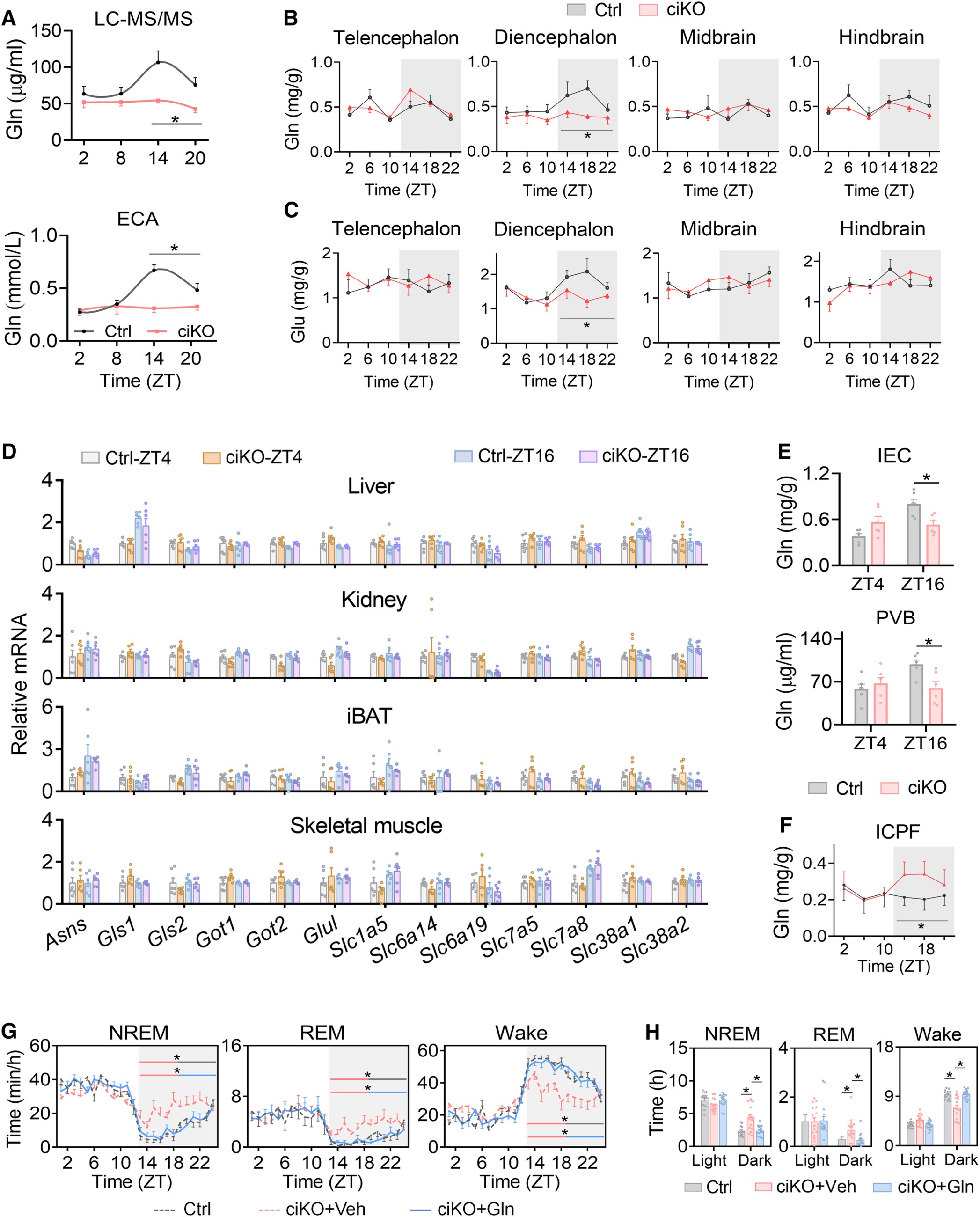
3. 肠道生物钟缺陷引发的睡眠异常源于谷氨酰胺稳态紊乱
代谢组学分析显示Bmal1-ciKO小鼠暗期循环及间脑谷氨酰胺水平降低(脑部GABA未受影响),而肝、肌等组织的生物钟功能、谷氨酰胺相关基因表达及自身谷氨酰胺水平无异常,核心原因是小鼠肠道谷氨酰胺吸收减少(小肠和门静脉谷氨酰胺降低、肠道内容物和粪便中谷氨酰胺升高),为验证组织(肝/肌)与循环谷氨酰胺池的分离关系,研究人员给小鼠灌胃 [U-13C5]-谷氨酰胺进行代谢流(同位素示踪)实验:发现13C5-谷氨酰胺仅短暂出现在血浆中,在肝与骨骼肌中无法检测到,证实循环与组织谷氨酰胺池相互独立;为达到谷氨酰胺的有效补充,通过夜间喂食含4%谷氨酰胺的饲料持续4周,可恢复Bmal1-ciKO小鼠暗期肠道、循环及间脑的谷氨酰胺水平,且能使小鼠昼夜睡眠—觉醒模式恢复正常,与对照组小鼠的睡眠状态趋于一致,由此证实谷氨酰胺稳态紊乱是肠道生物钟缺陷诱导睡眠异常的关键机制。
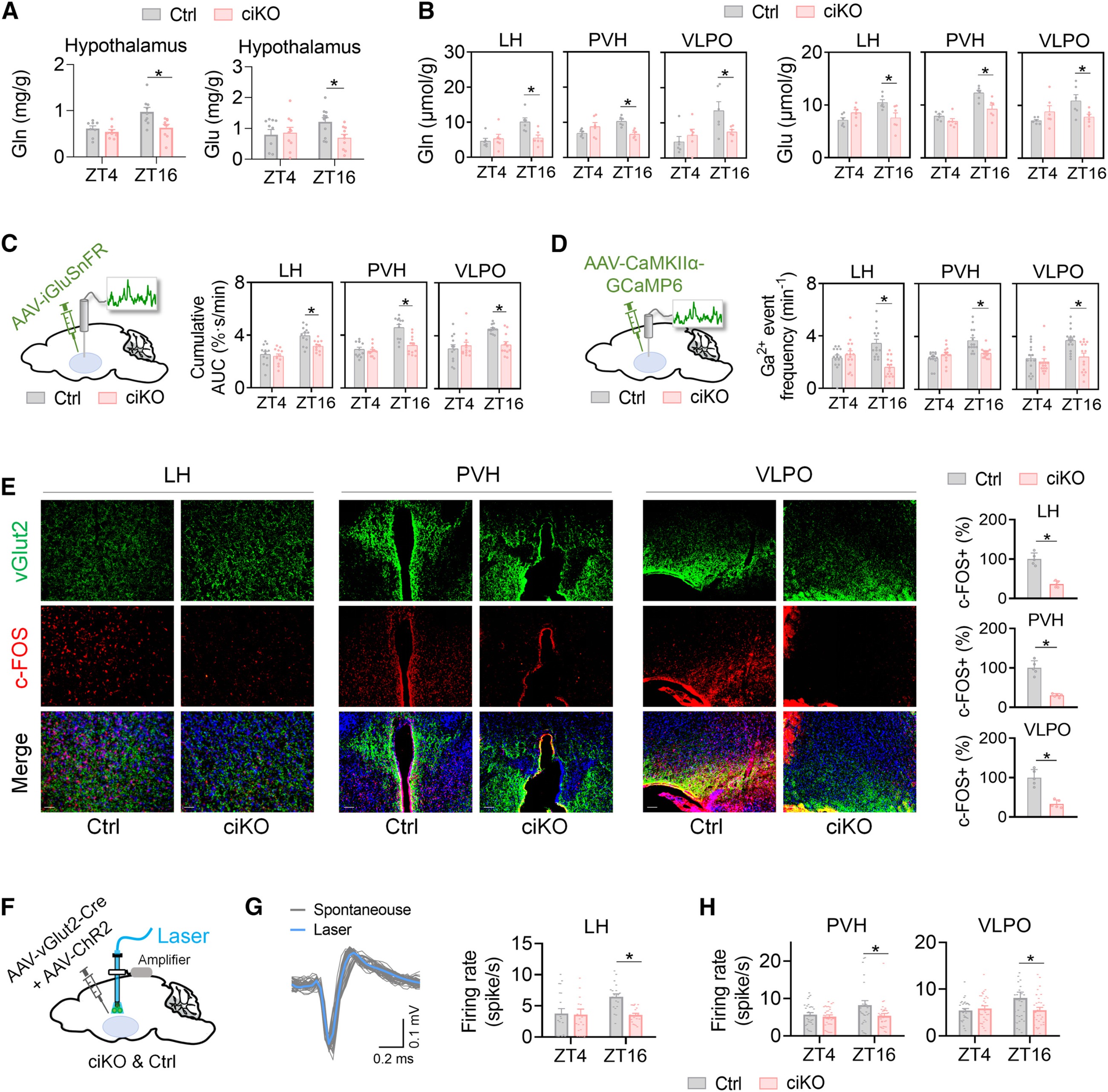
4.肠道Bmal1调控下丘脑谷氨酰胺能神经元活性
实验发现Bmal1-ciKO小鼠及肠道Bmal1沉默的野生型小鼠暗期下丘脑谷氨酰胺和谷氨酸水平降低,腹腔注射谷氨酰胺也仅特异性升高下丘脑谷氨酰胺水平;进一步检测显示,Bmal1-ciKO小鼠暗期外侧下丘脑(LH)、室旁下丘脑(PVH)和腹外侧视前核(VLPO)的谷氨酰胺 / 谷氨酸减少,通过光纤光度法(在体神经记录技术)证实这些核团的谷氨酸释放及谷氨酰胺能神经元活性降低,免疫染色和微电极阵列MEA(multi-electrode array)也验证了Bmal1-cKO 小鼠三个下丘脑核团谷氨酸能神经元的活性均呈下降趋势,且下丘脑内谷氨酰胺/谷氨酸代谢相关基因(Glul、Slc38a3和Slc38a5)的表达未受影响,表明上述变化源于循环谷氨酰胺稳态紊乱而非局部代谢改变,提示下丘脑谷氨酰胺能神经元参与肠道生物钟对睡眠-觉醒行为的调控。
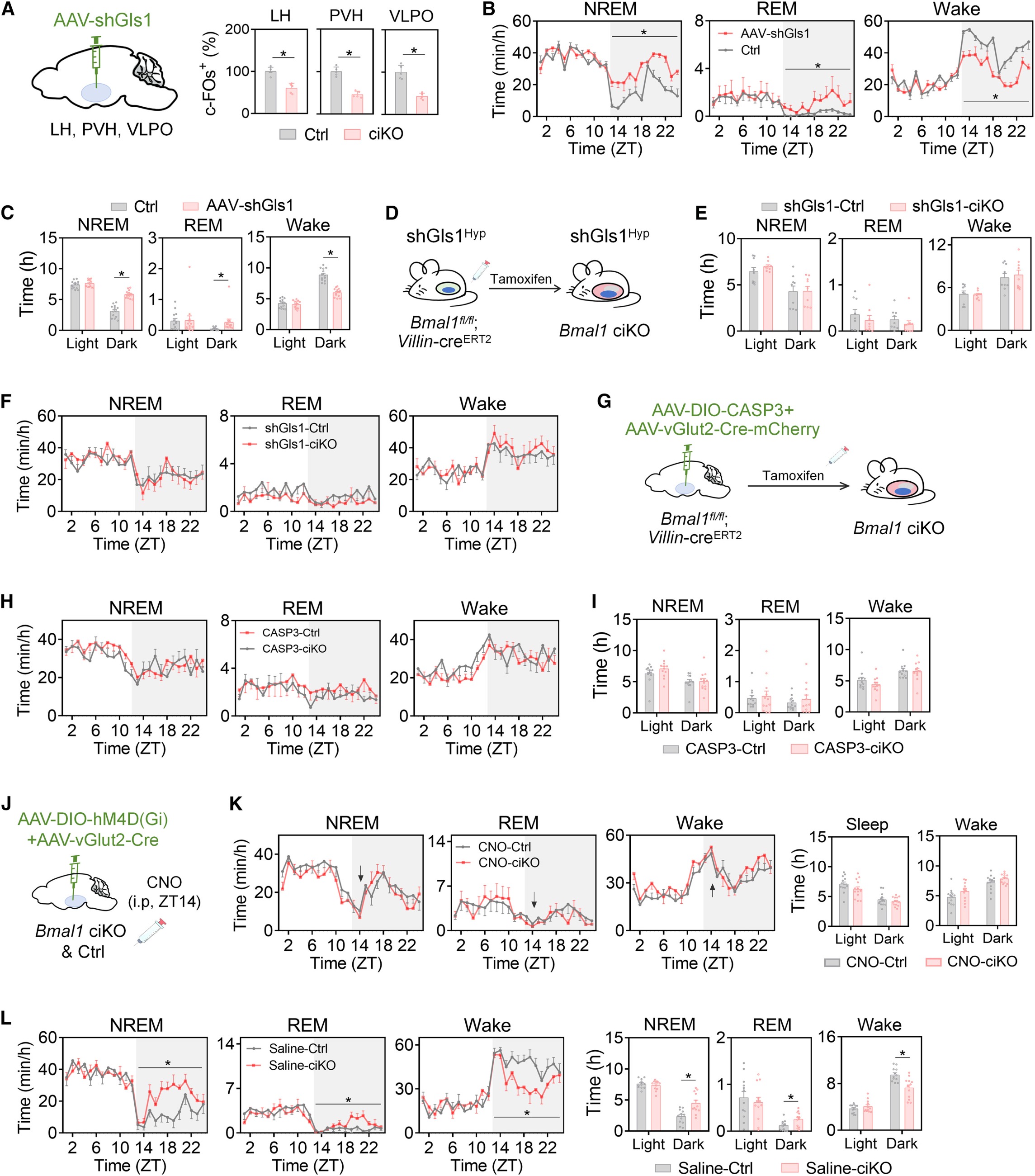
5.肠道生物钟对睡眠的调控依赖下丘脑谷氨酰胺能神经元
在野生小鼠中敲低 Gls1(谷氨酰胺脱氢酶 1)基因后,下丘脑三个核区的谷氨酸能活性显著降低,暗期觉醒减少、睡眠增加,表型与 Bmal1-ciKO 小鼠一致;进一步干预实验显示,使用AAV-vGlut2-Cre+AAV-DIO-Caspase3消融Bmal1fl/fl;Villin-creERT2(肠道特异性的 Bmal1条件性敲除小鼠)下丘脑谷氨酸能神经元,或化学遗传学失活实验技术—使用AAV-DIO-hM4D (Gi)+CNO抑制神经元活性,Bmal1-ciKO小鼠的睡眠-觉醒异常均被逆转—肠道Bmal1敲除不再影响睡眠,且抑制神经元后 Bmal1-ciKO与对照组觉醒时长无差异,证实下丘脑谷氨酰胺能神经元是肠道生物钟调控睡眠-觉醒行为的必需环节。
6.肠道BMAL1通过调控SLC6A19介导谷氨酰胺吸收
Bmal1-ciKO小鼠小肠中仅Slc6a19的mRNA和蛋白表达下调且节律减弱(其他谷氨酰胺转运体/代谢基因无变化),肠道过表达SLC6A19可恢复其循环及下丘脑谷氨酰胺水平与暗期睡眠模式,而野生型小鼠肠道沉默/敲除Slc6a19会显著降低谷氨酰胺吸收,进而使循环和下丘脑谷氨酰胺水平下降,在暗期的清醒时间减少、睡眠时长增加;在小鼠原代肠上皮细胞中的实验证实BMAL1可直接结合Slc6a19启动子的E-box元件,转录激活其表达,且BMAL1过表达/敲除分别上调/下调SLC6A19,Slc6a19 mRNA与蛋白水平的同步变化的节律表达也依赖BMAL1。
7. 肠道REV-ERBα以BMAL1依赖方式调控睡眠-觉醒周期
构建肠道特异性Rev-erbα敲除小鼠(Rev-erbα-ciKO),夜间BMAL1蛋白升高且相位偏移,其表型与Bmal1-ciKO相反—白天觉醒增加、睡眠减少,6 小时睡眠剥夺后NREM反弹减弱,同时白天肠道SLC6A19蛋白、谷氨酰胺吸收及循环/下丘脑谷氨酰胺水平升高,下丘脑谷氨酸能神经元活性增强;REV-ERBα拮抗剂 SR8278处理也呈现类似白天睡眠异常;而肠道沉默BMAL1后,Rev-erbα-ciKO不再影响小鼠睡眠-觉醒行为及谷氨酰胺稳态,证实肠道REV-ERBα对睡眠的调控需依赖BMAL1。
04 研究结论
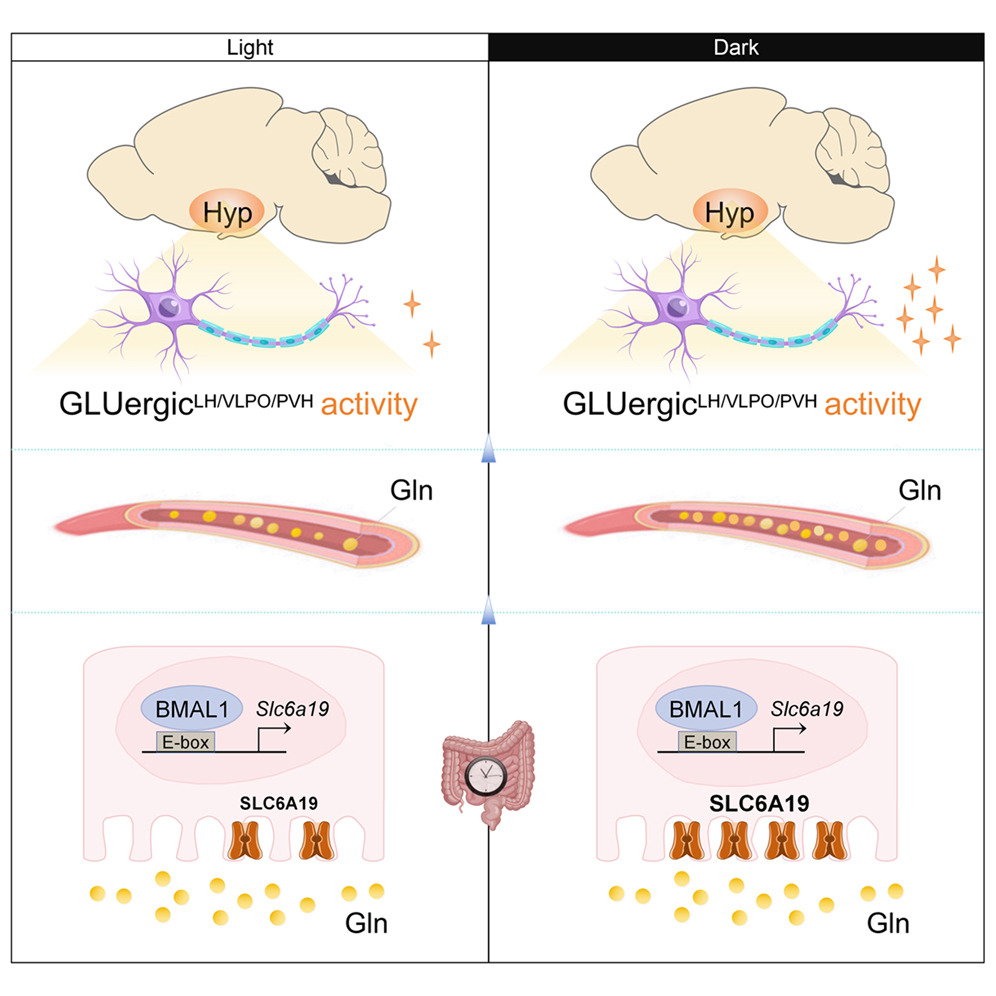
作者利用非靶代谢组学和代谢流技术等,对肠上皮细胞(IECs)中昼夜生物钟的功能进行深度剖析,结果表明,其完整性是维持日间睡眠 - 觉醒周期所必需的。在肠上皮细胞中,BMAL1 蛋白会驱动 SLC6A19 基因呈现日间节律性表达,这一过程能在活跃期促进肠道对谷氨酰胺的吸收,进而增强下丘脑核团中谷氨酸能神经元的活性,最终增加觉醒、减少睡眠。
谷氨酰胺稳态在睡眠 - 觉醒调控中的作用在静息期同样显著:若肠上皮细胞中 REV-ERBα 蛋白不足,会导致静息期谷氨酰胺水平升高,这与睡眠减少的睡眠异常存在直接因果关联。
综上,肠道生物钟通过时间性调控谷氨酰胺稳态来塑造日间睡眠 - 觉醒周期,这使其成为改善睡眠节律、干预睡眠障碍的潜在靶点。
05 知识拓展
传统 T3 柱(本篇文章中的非靶代谢组学所使用的柱子)虽能兼顾部分亲水与疏水性代谢物的检测,但单一的覆盖范围相当有限,难以满足非靶向代谢组学 “无偏向性” 的核心要求。要实现代谢组的全面覆盖,需针对不同极性代谢物的分离特性,整合多维度色谱 - 质谱技术平台:
反相色谱(RPLC)是常规非靶向代谢组学的核心分离技术,基于疏水作用实现分离,主要靶向疏水性 / 半疏水性代谢物,包括脂肪酸、酰基肉碱、磷脂、胆汁酸及部分氨基酸、芳香酸类等,是该类代谢物检测的主流方案;
亲水作用色谱(HILIC)为亲水性代谢物检测提供了关键解决方案,其对复杂样本中亲水性物质的分离解析能力突出,尤其适用于初级代谢通路(如糖酵解、三羧酸循环、戊糖磷酸途径)相关代谢物,以及核苷酸、氨基酸等亲水性分子的精准检测;
气相色谱 - 质谱联用(GC-MS)在特定类别代谢物检测中具有不可替代性,其优势集中于糖、糖醇、有机酸、胆固醇、维生素 E 及甾醇等物质,可有效弥补液相色谱 - 质谱(LC-MS)平台在该类代谢物检测中的短板。
因此,仅通过单一技术难以突破 “极性偏向性” 与 “类别局限性”;唯有将 RPLC-HRMS/MS(聚焦疏水性 / 半疏水性代谢物)、HILIC-HRMS/MS(聚焦亲水性代谢物)与 GC-MS(聚焦挥发性及特定极性代谢物)三大平台有机整合,构建多维度协同检测体系,才能彻底覆盖不同极性、不同类别代谢物,真正实现非靶向代谢组学 “无偏向性、全覆盖” 的核心技术要求。
谱领生物
谱领生物专注于高端代谢组和基于稳定性同位素示踪的代谢流等技术研发和服务,是国家级研发项目承担单位。谱领拥有齐全的高质量技术平台体系、庞大的自建内源性化合物标准品色谱质谱数据库、数百种稳定性同位素化合物内标。持续的技术革新和产品迭代,以及快速研发能力,为您的高质量研究保驾护航。




