Clinical Nutrition: 消化肿瘤营养不良精准诊断:代谢组学挖掘关键靶点,整合多指标构建精准营养诊断模型
利用代谢生物标志物biomarker实现疾病的早期筛查与精准预后,是当前研究的前沿方向。然而,实现这一目标面临多重挑战:首先是如何科学地构建入组队列,以确保研究样本的代表性与可靠性;其次,是设计队列分组,选择可靠的检测方法,确保检测的稳定性和可靠性;最终,采用严谨的统计指标,对候选标志物的区分度、准确度及临床适用性进行客观评估。这些都成为研究成败的关键所在,稳定和可靠的代谢检测方法是筛选一组有效代谢Biomarker的基石。
2025 年 10 月,由中国科学技术大学附属第一医院(安徽省肿瘤医院)李苏宜教授团队、山东大学齐鲁医学院何义富教授团队与谱领生物合作完成的研究,以 “Precise nutritional diagnosis in digestive system malignancies based on blood nutrients, inflammatory markers, intestinal function indicators and body composition” 为题,发表在《Clinical Nutrition》(IF=7.4),为消化系统恶性肿瘤精准营养诊断提供新依据。

01 研究背景
消化系统恶性肿瘤患者营养不良发生率高(中国多中心调查显示58.2%患者为中重度营养不良),且与炎症反应、肠功能障碍形成恶性循常规单一营养治疗忽视患者消化吸收、炎症状态,常规单一营养治疗忽视患者消化吸收、炎症状态,临床效果有限。“精准营养”是营养诊疗未来方向,但目前缺乏统一的精准营养诊断标准。该研究整合血浆代谢物、炎症标志物、血液营养物、肠功能指标及身体指标,探索消化系统恶性肿瘤患者的精准营养诊断方法,建立高准确性的精准营养诊断模型,为精准营养干预提供依据。
02 研究结果及内容
1.人群特征
该研究纳入140例消化系统恶性肿瘤患者,分严重营养不良组(87例)与营养良好组(53例)。研究组中位年龄更高、卡氏功能状态评分KPS(身体状态越好,评分越高)评分更低,采用生物电阻法BIA进行身体指标分析,结果表明,研究组的体重指数(BMI)、去脂体重指数(FFMI)、体脂率(BFP)及基础代谢率(BMR)均显著低于对照组,而肌肉下降率(MDR)更高。
2.患者营养代谢物的改变
通过UPLC-MS/MS对严重营养不良患者和营养良好的患者血浆进行了非靶向代谢组学研究,结果通过PLS-DA和OPLS-DA模型分析显示,严重营养不良与营养良好组间的血浆代谢物存在显著分离。经200次置换检验验证模型有效后,共鉴定出129种差异代谢物,其中营养不良组56种下调、73种上调。重点分析发现:必需氨基酸代谢紊乱(色氨酸及其中间代谢物下降而下游产物累积,赖氨酸等三种氨基酸升高);脂质代谢异常(20种肉碱升高,31种磷脂降低);核酸代谢物尿苷/尿嘧啶减少;维生素A下降,4-吡哆酸升高;微生物代谢物邻苯二酚硫酸盐显著降低。通路分析进一步揭示嘧啶代谢、甘油磷脂代谢、色氨酸代谢等5条核心通路在组间具有显著差异,系统揭示了严重营养不良患者特有的代谢网络失衡特征中的扩增起着关键作用。
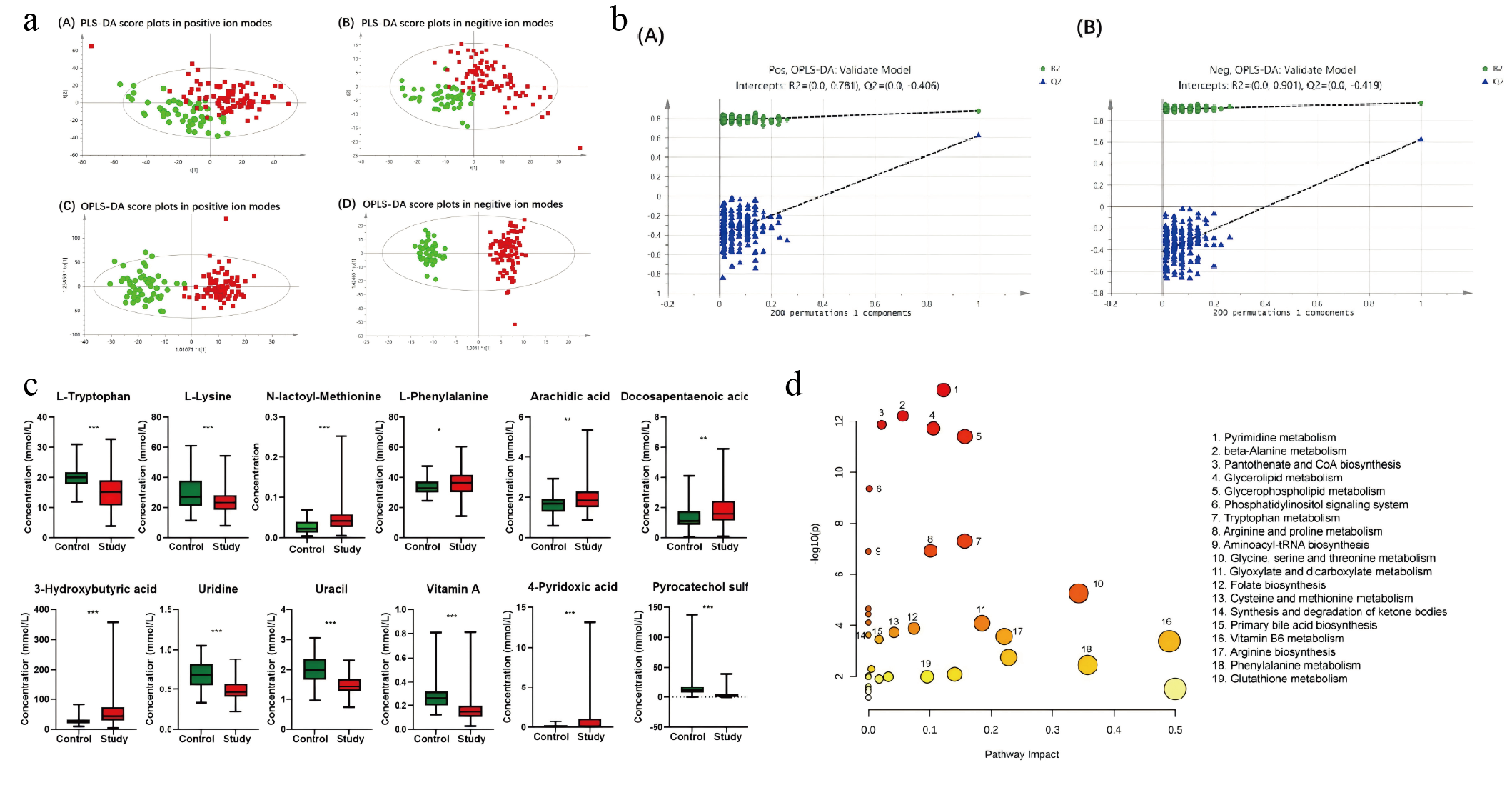
图1 血浆非靶代谢组学 a.血浆样本的偏最小二乘判别分析(PLS-DA)与正交偏最小二乘判别分析(OPLS-DA)得分图 b.正、负离子模式下正交偏最小二乘判别分析(OPLS-DA)模型的置换检验图 c.组间主要特异性代谢物箱线图 d.两组差异代谢物的代谢通路概述图
3.炎症标志物
在针对消化系统恶性肿瘤患者的研究中,严重营养不良组(研究组,n=87)与营养良好组(对照组,n=87)的炎症标志物及部分肠黏膜屏障功能指标存在显著差异:炎症标志物方面,研究组的C反应蛋白(CRP)、白细胞介素-6(IL-6)中位数水平,中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、全身免疫炎症指数(SII),以及降钙素原(PCT)异常率均显著高于对照组;肠黏膜屏障功能指标中,仅D-乳酸在研究组显著升高,内毒素(LPS)和二胺氧化酶(DAO)无显著差异,这些结果表明严重营养不良患者存在多种炎症因子水平升高的情况,可将其作为营养诊断的参考指标之一。
4.肠道功能指标
D-乳酸(肠黏膜屏障功能指标之一)在严重营养不良的研究组外周血水平显著高于营养良好的对照组,但两组LPS和DAO无显著差异;为探究肠道菌群与肠功能的关联,对22名参与者(研究组16人,含12例上消化道肿瘤、4例结直肠癌;对照组6人,含 3 例上消化道肿瘤、3例结直肠癌)的粪便样本进行全基因组测序,结果显示细菌菌群组成及多样性有差异,研究组整体肠道菌群Alpha多样性下降不显著,但其中上消化道肿瘤患者菌群多样性显著降低,结直肠癌患者无显著差异;门水平上研究组疣微菌门显著富集(LAD>2.5),属水平上两组16种菌群丰度有差异(研究组2个属富集、对照组14个属富集)。
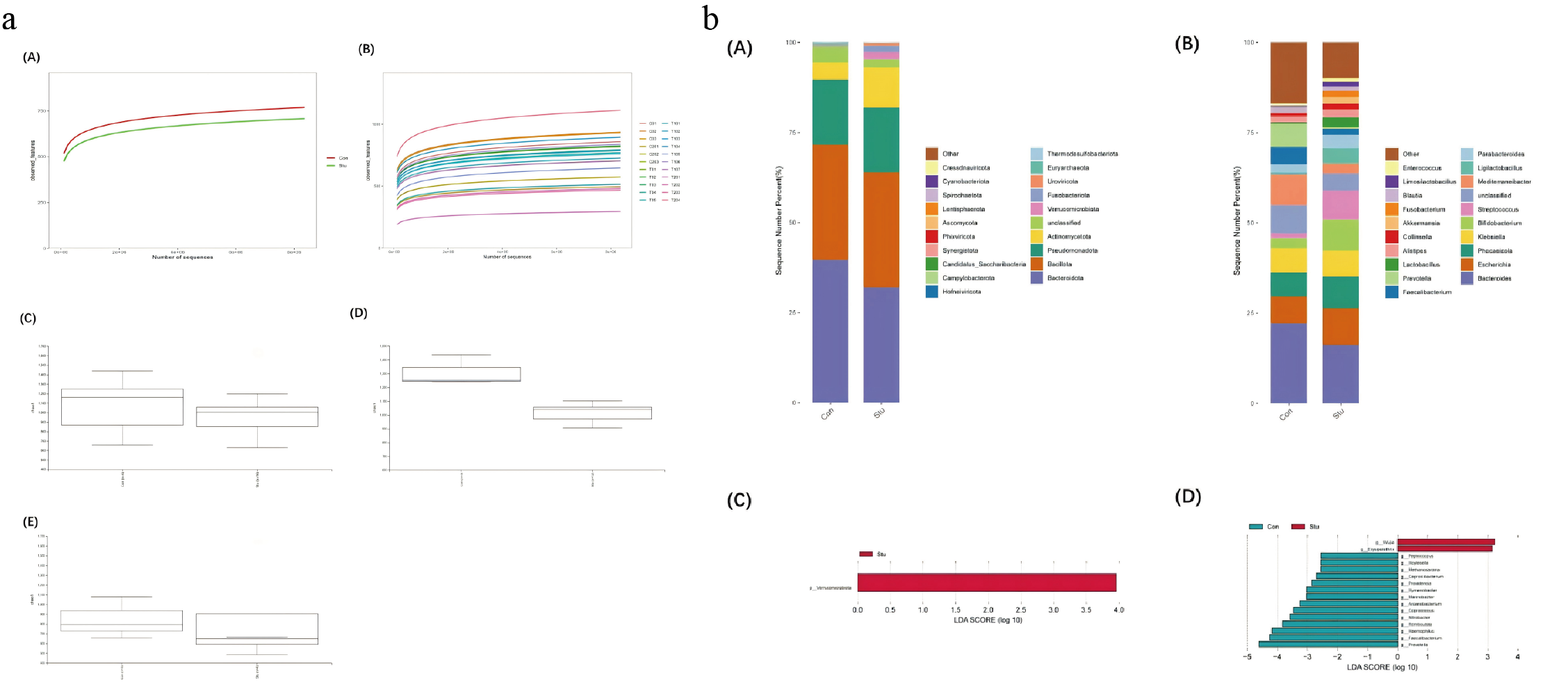
图2 粪便全基因测序 a.肠道菌群分析(A)两组人群的菌群物种稀释曲线;(B)所有患者的肠道菌群物种稀释曲线;(C)所有患者的肠道菌群α多样性;(D)上消化道肿瘤患者的肠道菌群 α 多样性;(E)结直肠癌患者的肠道菌群 α 多样性。 b.肠道菌群门水平与属水平分析(A)门水平肠道菌群物种相对丰度柱状图;(B)属水平肠道菌群物种相对丰度柱状图;(C)门水平肠道菌群线性判别分析效应量(LEfSe)分析柱状图;(D)属水平肠道菌群线性判别分析效应量(LEfSe)分析柱状图
5.精准营养诊断模型
本研究以临床相关性与生物学意义、统计学显著性、实际可获取性及可测量性为核心依据筛选特征指标,优先选择与营养状态、炎症反应及肠功能有明确生物学关联的指标,构建了高效且具临床转化价值的精准营养诊断模型;差异代谢物初步筛选优先关注必需氨基酸等营养相关类别,再筛选VIP>1.5的代谢物,确定L-色氨酸、尿苷、维生素A、儿茶酚硫酸盐为初步候选代谢物,排除对预测性能贡献微小的N-乳酰甲硫氨酸等,炎症因子中IL-6对模型预测价值贡献最显著且与癌症相关恶液质等直接相关,故作为核心炎症标志物纳入,D-乳酸因预测贡献有限被排除,BMI因应用广泛、获取便捷被纳入,最终通过回归分析确定上述6个指标构建模型,其预测概率公式为logit(p)=(20.875–0.174×L-色氨酸–1.856×尿苷–10.774×维生素A–0.164×儿茶酚硫酸盐+0.197×IL-6–0.569×BMI),该模型AUC达0.979、Youden指数0.866(数值越接近1,诊断价值越高),具有优异诊断与预测价值。
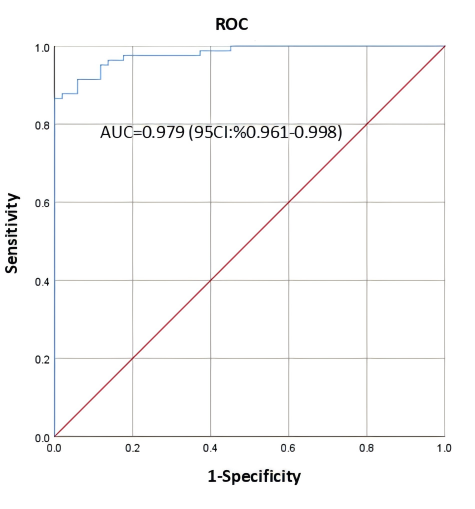
图3 基于6个指标的诊断模型
03 研究结论
本研究证实严重营养不良的消化系统恶性肿瘤患者存在显著代谢异常、炎症反应增强及肠功能障碍,表明统一营养干预不足,需重视个性化方案;该研究初步探索了此类患者精准营养诊断的潜在靶点,且整合代谢组学生物标志物、炎症标志物与BMI的精准营养诊断模型展现出较高诊断效能,未来需开展纵向、前瞻性临床试验验证该模型,并基于个体化精准营养诊断探索针对性治疗策略。
谱领生物
谱领生物提供了临床血浆样本的非靶向代谢组学检测服务,准确检测140例消化系统恶性肿瘤患者(87例严重营养不良、53例营养良好)血浆样本,采用规范的血浆样本前处理流程、空白样本、QC样本及内标校正,从多维度质控充分保障数据的稳定性与准确性。检测结果兼具稳定性和临床意义,成功识别出129种差异代谢物,覆盖必需氨基酸、脂肪酸、核苷酸等核心营养相关类别,且筛选出的L-色氨酸、尿苷等关键代谢靶点,后续与IL-6、BMI等整合构建的精准营养诊断模型,充分证明代谢组学数据不仅稳定可靠,更能为临床诊断提供高价值支撑。




