Cell Metab: 代谢流技术锁定T细胞免疫关键通路:葡萄糖驱动糖鞘脂合成,撑起抗肿瘤免疫防线!
01 文章信息

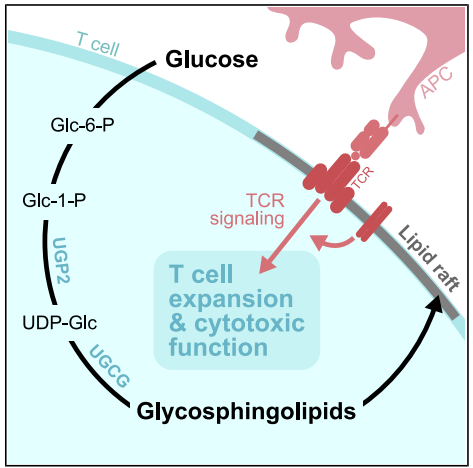
文章标题:Glucose-dependent glycosphingolipid biosynthesis fuels CD8+ T cell function and tumor control
期刊:Cell Metabolism
online:2025.8.5
影响因子:27.7
谱领生物提供领先的代谢流(Metabolic Flux)、代谢组和脂质组检测服务。
02 研究背景
在抵御感染和癌症中,葡萄糖是T细胞增殖和功能的关键,效应T细胞(Teff)通过代谢重编程增强葡萄糖摄取。除通过糖酵解和氧化磷酸化供能外,体内CD8+ Teff细胞更倾向将葡萄糖碳源用于核苷酸、脂质等生物合成,以支持其增殖与功能。然而,生理状态下调控这些关键葡萄糖代谢途径的具体机制仍不明确。
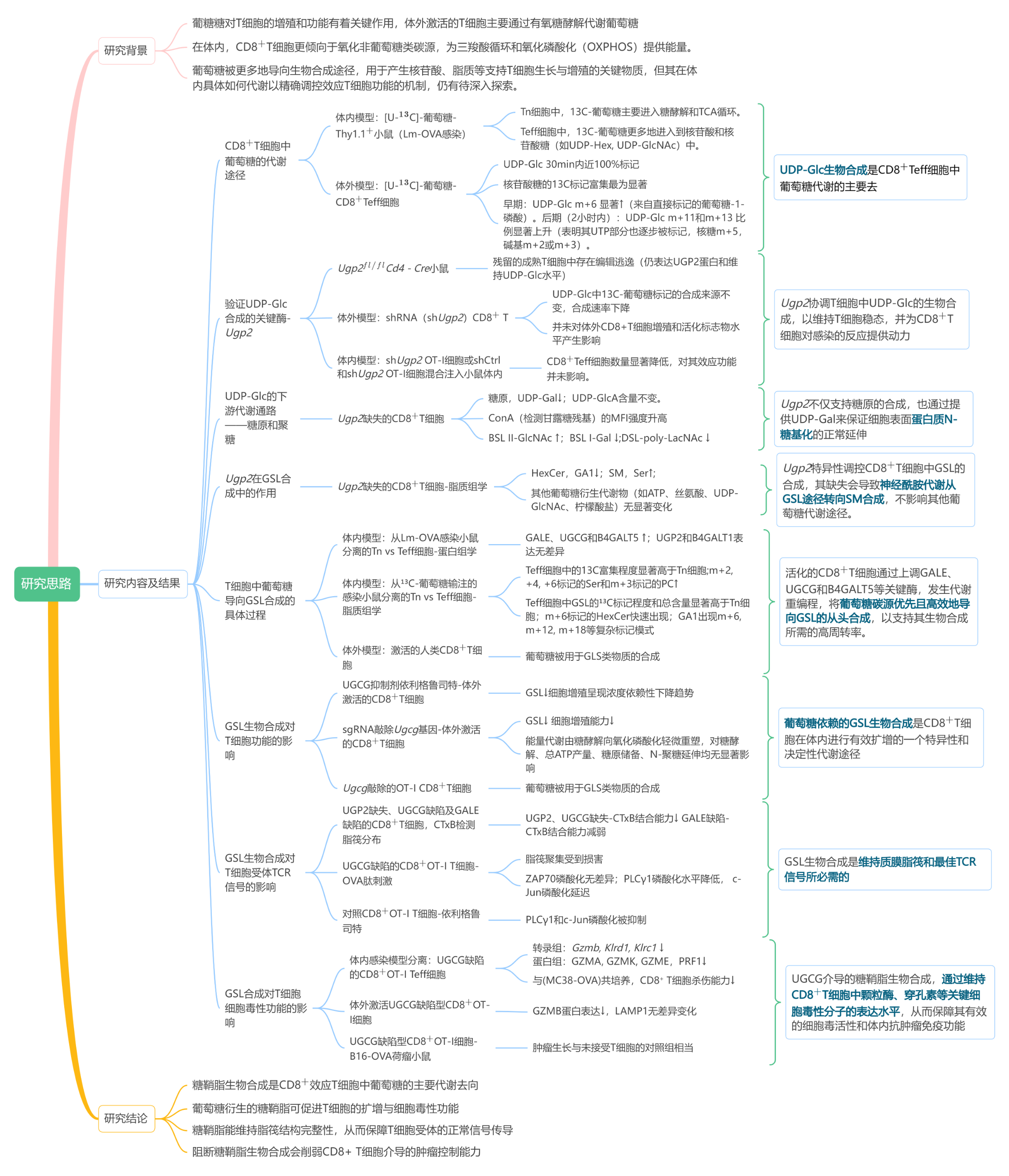
03 研究思路
04 研究内容及结果
1.UDP-Glc生物合成是葡萄糖在生理激活的CD8+ T细胞中的主要代谢
作者采用体内13C-同位素示踪技术揭示了葡萄糖在生理激活的CD8+ T细胞中的主要代谢途径,将Thy1.1+ CD8+ OT-I T细胞(Thy1.1追踪标签、可特异性识别OVA抗原)注入到感染了带有相同抗原的减毒李斯特菌(Lm-OVA)的小鼠中,感染高峰期后,通过尾静脉向小鼠输注[U-13C]-葡萄糖持续2小时,从脾脏中分离T细胞进行代谢分析。结果表明,在效应 T 细胞(Teff细胞)中,13C-葡萄糖更多地进入到核苷酸和核苷酸糖,其中UDP-葡萄糖(UDP-Glc)的生物合成尤为突出。为了进一步验证这一发现,作者将体外培养的T细胞进行代谢分析,Teff细胞中UDP-Glc总量提升约6倍,50%的UDP-Glc池在15分钟内即可被标记,30分钟内近乎完全更新。进一步的同位素分布动态分析表明,UDP-Glc的合成整合了来自糖酵解、磷酸戊糖途径及三羧酸循环的多条通路。这些结果揭示了UDP-Glc生物合成是CD8+ Teff细胞中葡萄糖代谢的主要去向。
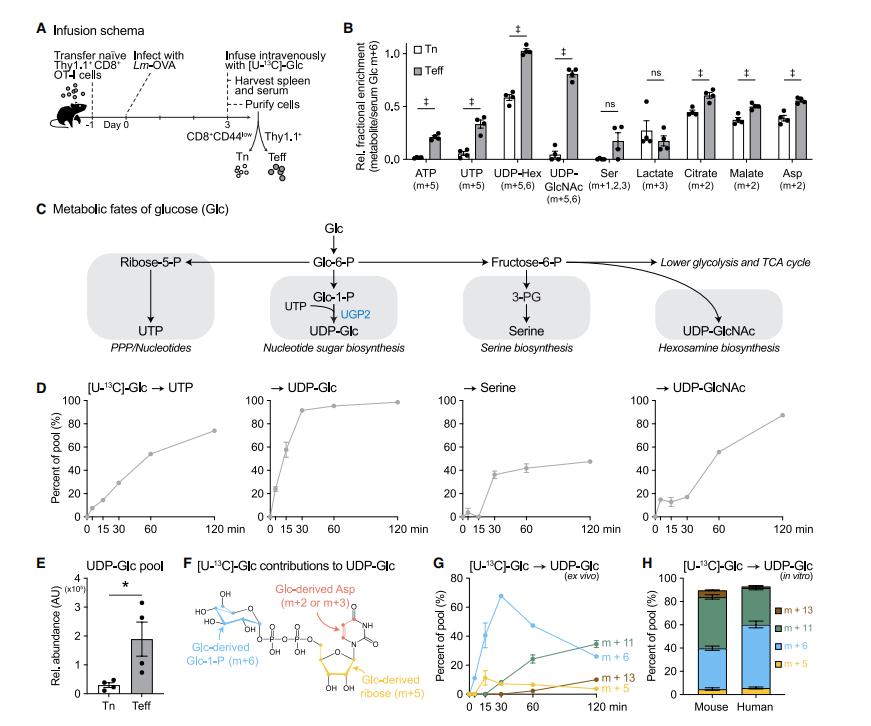
图 1 UDP-Glc生物合成是葡萄糖在生理激活的CD8+ T细胞中的主要代谢途径
2.UGP2通过调控T细胞中UDP-Glc的生物合成以维持T细胞稳态,并为CD8+ T细胞抗感染应答提供代谢支持
UGP2是催化UDP-Glc合成的关键酶,实验结果表明UGP2缺陷会导致体外激活的CD8⁺ T细胞中UDP-Glc合成显著减少,并未对体外的细胞增殖产生影响,进一步验证UGP2耗竭对CD8+ T细胞功能的影响,作者构建了Ugp2基因敲除小鼠(将shUgp2 OT-I细胞注入小鼠体内),实验结果显示抗原特异性的CD8+ T效应细胞数量显著降低。这些结果共同表明,UGP2体外对CD8+ T细胞增殖或存活影响较小,但在体内其对T细胞稳态及感染应答中的扩增起着关键作用。
3.UDP-葡萄糖支持CD8+ T细胞中糖原与聚糖的生物合成
接下来,作者研究了UDP-Glc生物合成的下游通路——糖原和聚糖的合成。对激活的Ugp2缺失的CD8+ T细胞进行代谢组学分析发现,糖原合成减少,合成UDP-Glc的前体物质UDP-半乳糖(UDP-Gal)显著减少,UDP-葡糖糖醛酸(UDP-GlcA)水平不变,UDP-Gal是β-1,4-半乳糖基转移酶(B4GALTs)的底物,负责糖蛋白和糖脂的糖基化。通过多种凝集素分析发现,UGP2缺失的CD8+ T细胞表面末端N-乙酰葡萄糖胺增加、半乳糖和聚-N-乙酰乳糖胺(poly-LacNAc)结构显著减少。这些数据表明,阻断UDP-Gal合成会特异性阻碍N-聚糖链的延伸与成熟,最终重塑了CD8+ T细胞表面糖萼的组成结构。
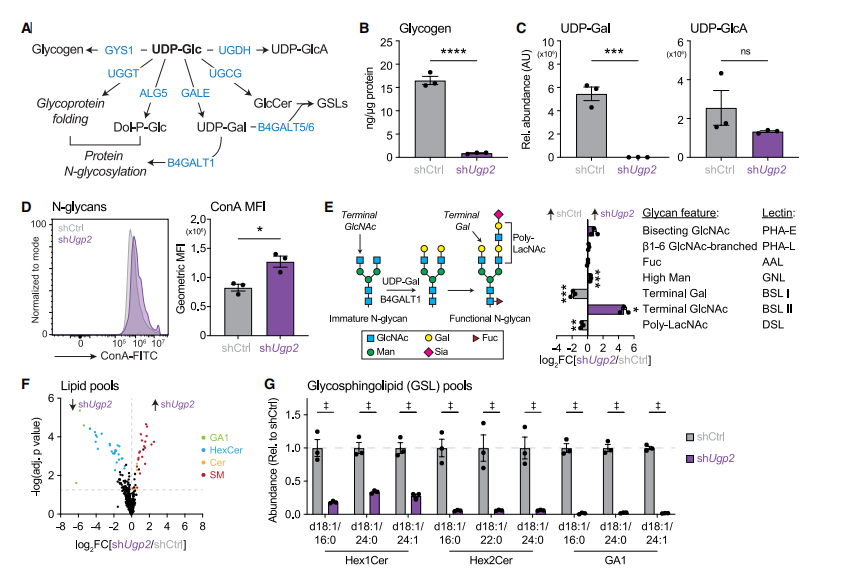
图 2 UDP-Glc在体外激活CD8+ T细胞中促进糖原生物合成和UDP-Gal依赖性代谢过程
4.UGP2是CD8+ T细胞中GSL生物合成所必需
为探究UGP2缺失对GSL生物合成的影响,对Ugp2缺失的CD8+ T细胞进行脂质组学分析。结果发现在Ugp2缺失的T细胞中,多种己糖基神经酰胺(HexCer)和GA1型神经节苷脂的含量显著降低,而多种神经酰胺及其衍生的鞘磷脂含量则明显升高,这表明当UGP2缺失时,神经酰胺会从己糖基神经酰胺的生物合成途径转向其他脂质代谢通路进行转化,而不干扰其他与T细胞增殖相关的葡萄糖衍生代谢物。
5.CD8+ T细胞将葡萄糖导向体内为GSL生物合成提供燃料
为探究UDP-Glc/UDP-Gal依赖性代谢通路如何随T细胞活化而变化,作者分析了从Lm-OVA感染小鼠体内分离的CD8+ Tn细胞和Teff细胞的蛋白质组学数据,结果表明Teff细胞中催化UDP-Glc转化为UDP-Gal的关键酶GALE、以及GSL合成核心酶UGCG和B4GALT5的表达均显著上调。接着通过小鼠体内[U-13C]-葡萄糖示踪实验进一步证实Teff细胞具有活跃的脂质从头合成能力,其中己糖基神经酰胺(HexCer)和GA1神经节苷脂等GSLs的13C标记程度与总含量均显著高于Tn细胞。值得注意的是,在标记仅2小时后即可观察到m+6标记的HexCer相对富集度增加约20%,表明GSLs在Teff细胞中具有极高的周转速率。对GA1神经节苷脂的同位素分析还显示存在m+12和m+18等同位素异构体,证明葡萄糖碳参与了其糖链头部和神经酰胺尾部的共同合成。
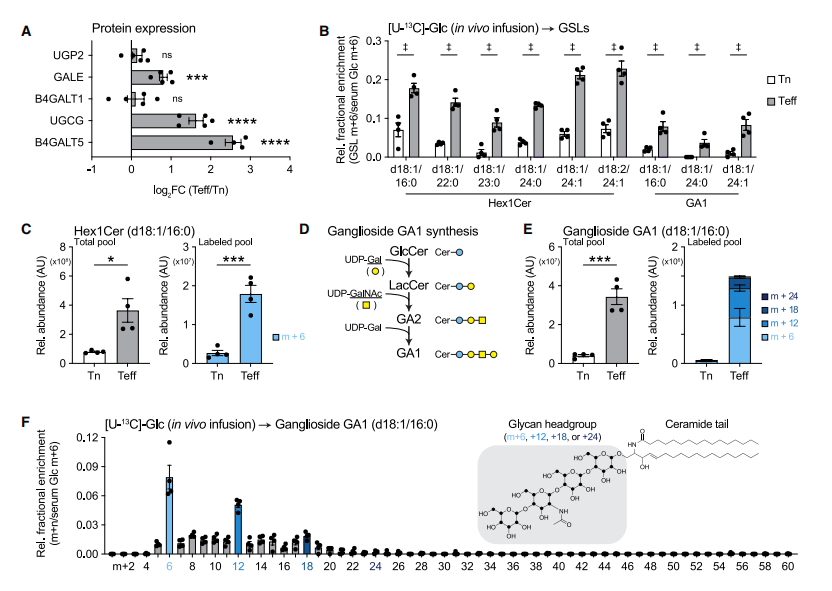
图 3 CD8+ T细胞将葡萄糖导向体内GSL生物合成
6.葡萄糖依赖性GSL生物合成对T细胞体内扩散至关重要
为探究葡萄糖依赖性GSL生物合成对体内CD8+ T细胞应答的贡献,作者通过UGCG(催化GSL合成的第一步酶)药物抑制(Eliglustat)和基因敲除(Ugcg sgRNA)两种策略,证实GSL生物合成对CD8+ T细胞体内应答具有关键作用。抑制UGCG酶活或敲除Ugcg基因均显著降低GSL含量,并特异性削弱CD8+ T细胞体外增殖能力及体内Teff细胞扩增,但不影响细胞活力、分化、细胞因子产生及糖原储备等基本功能。协同实验表明,敲除下游GALE酶同样损害Teff细胞扩增。
7.GSL生物合成是维持质膜脂筏和最佳TCR信号所必需的
为了探究GSL生物合成是如何影响TCR信号传导的,作者对GSL合成缺陷的CD8+ T细胞进行了脂筏聚集评估,UGP2或UGCG缺失均导致T细胞中脂筏聚集受损。UGCG敲除的T细胞在TCR激活,早期信号分子ZAP70磷酸化正常,但下游PLCγ1磷酸化降低和c-Jun磷酸化延迟,表明GSL合成缺陷通过破坏脂筏完整性特异性阻碍远端TCR信号传导。
8.UGCG控制CD8+ T细胞的细胞毒性功能和抗肿瘤免疫
最后,作者通过多组学联合分析揭示了GSL生物合成对CD8⁺ T细胞毒性功能的影响。转录组与蛋白质组学数据显示,UGCG缺陷导致颗粒酶家族成员(GZMA/GZMK/GZME)和穿孔素(PRF1)表达显著下调,关键细胞毒性通路被系统性抑制。UGCG缺陷细胞需2倍数量才能达到野生型细胞的杀伤效果,且体内外实验均显示其效应分子颗粒酶B(GZMB)表达显著降低。值得注意的是,这种功能缺陷源于细胞毒性蛋白储备不足,脱颗粒标志物LAMP1无差异变化。在B16-OVA荷瘤小鼠模型中,Ugcg缺陷的OT-I细胞完全丧失肿瘤控制能力。这些结果阐明UGCG通过调控GSL合成维持T细胞毒性蛋白表达,从而保障抗肿瘤免疫应答的有效实施。
05 研究结论
本研究通过代谢流技术揭示了CD8+ T细胞中葡糖糖代谢的核心通路。研究结果表明,在活化的CD8+ T细胞中,葡萄糖主要被用于UDP-Gcl的合成,且UDP-Glc能够进一步合成GSL。机制研究表明,阻断GSL合成通路会特异性削弱CD8+ T细胞的扩增、细胞毒性效应及抗肿瘤免疫应答能力,最后揭示GSL通过维持质膜脂筏的结构完整性从而保障T细胞受体(TCR)信号通路的有效激活和传导。
该研究揭示了GSL生物合成是葡萄糖驱动的关键通路,能够促进CD8+ T细胞在体内的扩增和细胞毒性功能。