Cell Metab: 代谢流技术发现丙酮酸代谢酶DLAT的双重促癌机制!
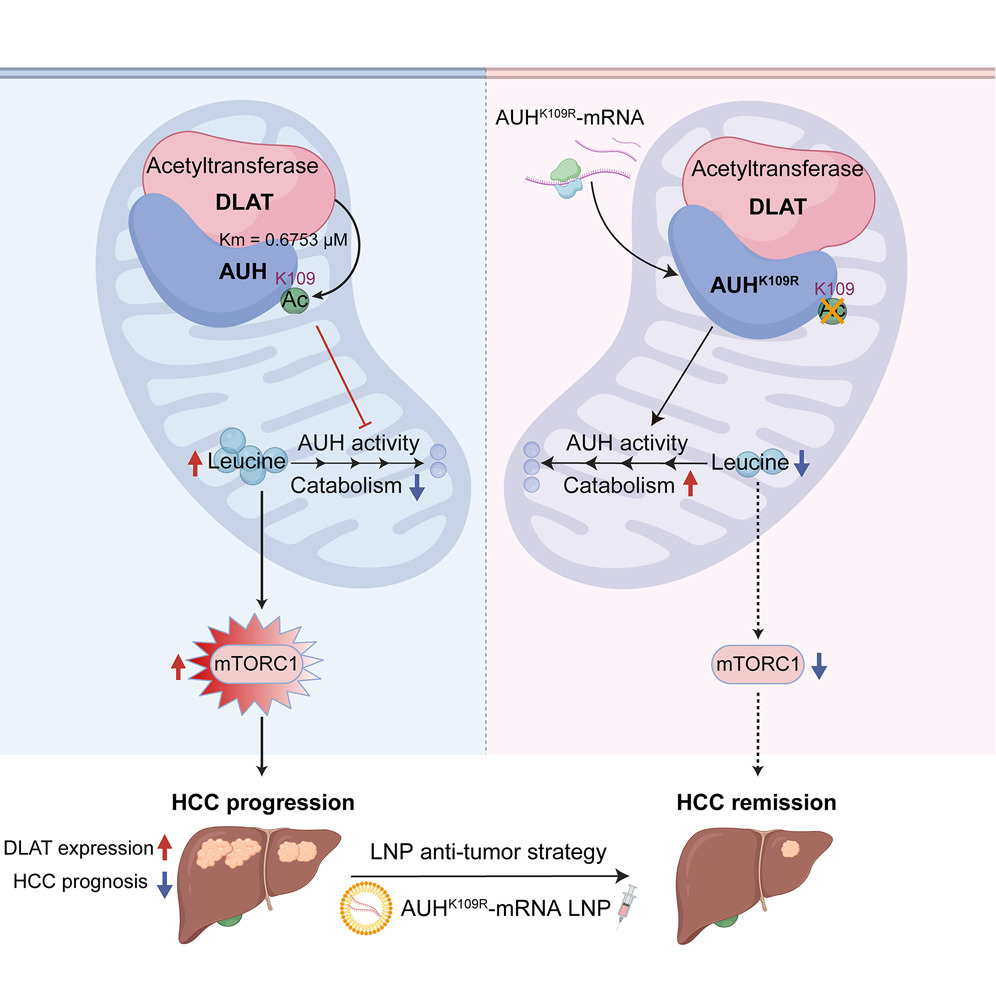
肝细胞癌(HCC)全球发病率与死亡率持续上升,其进展与代谢重编程密切相关,主要表现为Warburg效应和支链氨基酸(BCAA)代谢紊乱。随着代谢流技术(稳定性同位素示踪)的发展,肝癌代谢的特异性逐渐被揭示出来。基于此,研究者提出了靶向治疗肝癌的新途径和策略。2025年3月,上海交通大学刘军团队在Cell Metabolism(IF30.9)发表标题为“Pyruvate metabolism enzyme DLAT promotes tumorigenesis by suppressing leucine catabolism”的研究论文。该团队主要利用代谢流和乙酰蛋白组学技术揭示丙酮酸代谢酶DLAT与亮氨酸分解代谢的相互作用机制,DLAT直接乙酰化亮氨酸分解酶AUH的第109位赖氨酸(K109),抑制AUH活性并促进亮氨酸累积,进而持续激活mTOR复合体,促进HCC的进展。基于此机制,该团队提出并验证了AUHK109R-mRNA脂质纳米颗粒(LNP)靶向治疗HCC的策略。
谱领生物提供中心碳代谢和支链氨基酸代谢流检测技术服务
一、研究背景
近年来,代谢重编程研究揭示了丙酮酸(Warburg效应的核心代谢中间体)及其丙酮酸代谢在肿瘤的发生发展中的关键调控作用。作为连接糖酵解和三羧酸(TCA)循环的重要代谢枢纽,丙酮酸脱氢酶(PDH)复合体由PDHE1、PDHE2和PDHE3三种催化酶组成。其中PDHE2(即二氢硫辛酰胺乙酰转移酶,DLAT)不仅作为PDH复合体的核心乙酰转移酶催化乙酰辅酶A生成,还作为蛋白质乙酰转移酶蛋白,在维持细胞生长和存活中发挥重要作用。然而,DLAT是否还通过协调调节其他代谢途径(如支链氨基酸代谢)来促进肿瘤生长,这一科学问题仍有待阐明。值得注意的是,支链氨基酸(BCAA)在癌症代谢和肿瘤发生中扮演着关键角色。特别是在支链氨基酸(BCAA)代谢中,亮氨酸通过激活mTORC1信号通路显著促进肝癌发展。在BCAA分解代谢途径中,AU RNA结合甲基戊二酮辅酶A水合酶(AU RNA binding methylglutaconyl-CoA hydratase,AUH)因其独特的作用而备受关注:作为亮氨酸分解代谢中的限速酶,AUH特异性催化S-3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)的生成。然而,目前对AUH代谢活性的调节及其在肿瘤进展中的生物学功能尚不清楚。尽管丙酮酸代谢和BCAA分解代谢均在癌症及肿瘤的发展中发挥重要作用,但是这两条代谢通路之间的相互作用尚未明确,亟待深入探究其分子机制。本文重点展示了基于稳定性同位素示踪的代谢流技术是如何发现这两条通路之间的相互作用机制以及丙酮酸代谢酶DLAT的双重促癌机制。
二、研究内容与结果
1. DLAT在HCC中的高表达与预后不良相关,其靶向抑制在体内外显著抑制HCC增殖
作者首先采用COX生存分析筛选与丙酮酸代谢相关的肝癌风险因子。从代谢相关基因集中筛选到四个基因表达与肝癌风险比升高显著相关:乳酸脱氢酶A(LDHA)、苹果酸酶2(ME2)、苹果酸酶1(ME1)以及PDH复合体E2亚基DLAT(图1)。由于其它几个基因已有大量研究,因此作者的研究聚焦于影响HCC预后的关键基因—二氢硫辛酰胺乙酰转移酶(DLAT,丙酮酸脱氢酶E2亚基)。基于肝细胞癌基因组图谱、多个GEO独立数据集的差异基因分析及单细胞测序、空间转录组数据分析,一致证实DLAT在肝癌组织和恶性肿瘤细胞中特异性高表达,且其表达水平与恶性肿瘤细胞正相关。更重要的是,靶向抑制DLAT在体内外模型中均展现出显著的抑制HCC增殖效应。体外构建DLAT敲除细胞系(MHCC-97H-sgDLAT, Huh7-sgDLAT, HepG2-sgDLAT)显著抑制细胞增殖;体内构建肝癌模型——DLAT敲除细胞的皮下异种移植瘤、肝脏特异性敲低DLAT的MYC/Trp53+/-基因工程鼠模型、以及DLAT杂合敲除鼠(DLAT-HKO)的DEN/CCl₄化学诱导肝癌模型均一致证实,DLAT缺失能显著降低肿瘤生长速率、体积、数量及Ki-67阳性增殖指数。这些结果充分表明DLAT是驱动HCC进展的关键因子,靶向DLAT是抑制肝癌增殖的有效途径。
2. DLAT敲除对TCA循环代谢产物无显著影响
DLAT在丙酮酸代谢中发挥关键作用。虽然非靶向代谢组学分析显示DLAT敲除细胞(Huh7-sgDLAT)和对照组细胞TCA循环中间产物(柠檬酸和顺乌头酸)总含量并未出现显著差异(图1、图3A),但出乎意料的是,[U-13C]丙酮酸示踪实验证实DLAT缺失显著降低了丙酮酸来源的乙酰辅酶A和TCA循环中间物的生成(图2A-F)。值得注意的是,当葡萄糖或丙酮酸代谢受损时,肝细胞可通过增强谷氨酰胺分解代谢维持TCA循环稳态。这一补偿机制在HepG2-sgDLAT细胞[U-13C]谷氨酰胺代谢流分析中得以证实,即DLAT缺失显著增加了谷氨酰胺来源的TCA中间产物(如α-酮戊二酸和顺乌头酸)的代谢流(图2G-J)。定量分析进一步表明,谷氨酰胺分解代谢的增强足以补偿DLAT抑制对TCA循环中间产物的影响。
因此,非靶向代谢组学技术对于DALT敲除的代谢结果显然是失效的,而代谢流技术则揭示了HCC细胞在DLAT缺失时的代谢重编程机制,当DLAT功能缺失导致丙酮酸氧化途径受阻时,细胞通过激活谷氨酰胺分解代谢等补充TCA循环中间体,从而维持能量代谢稳态。这一代谢适应性可能是HCC细胞在能量应激条件下维持生存的重要策略。
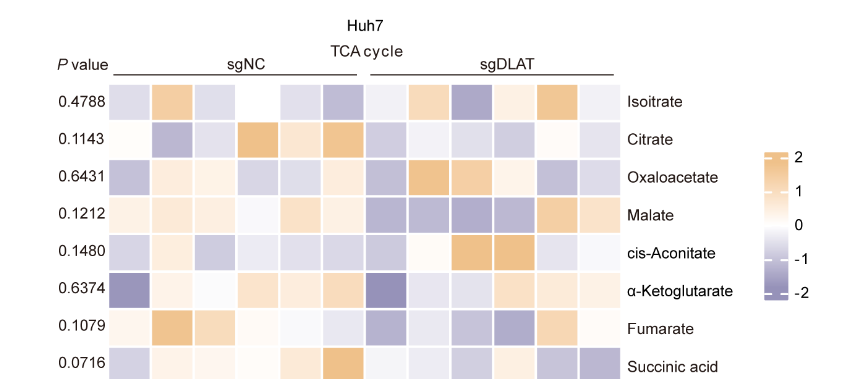
图1. DLAT 缺失对 TCA 循环中间产物的影响有限
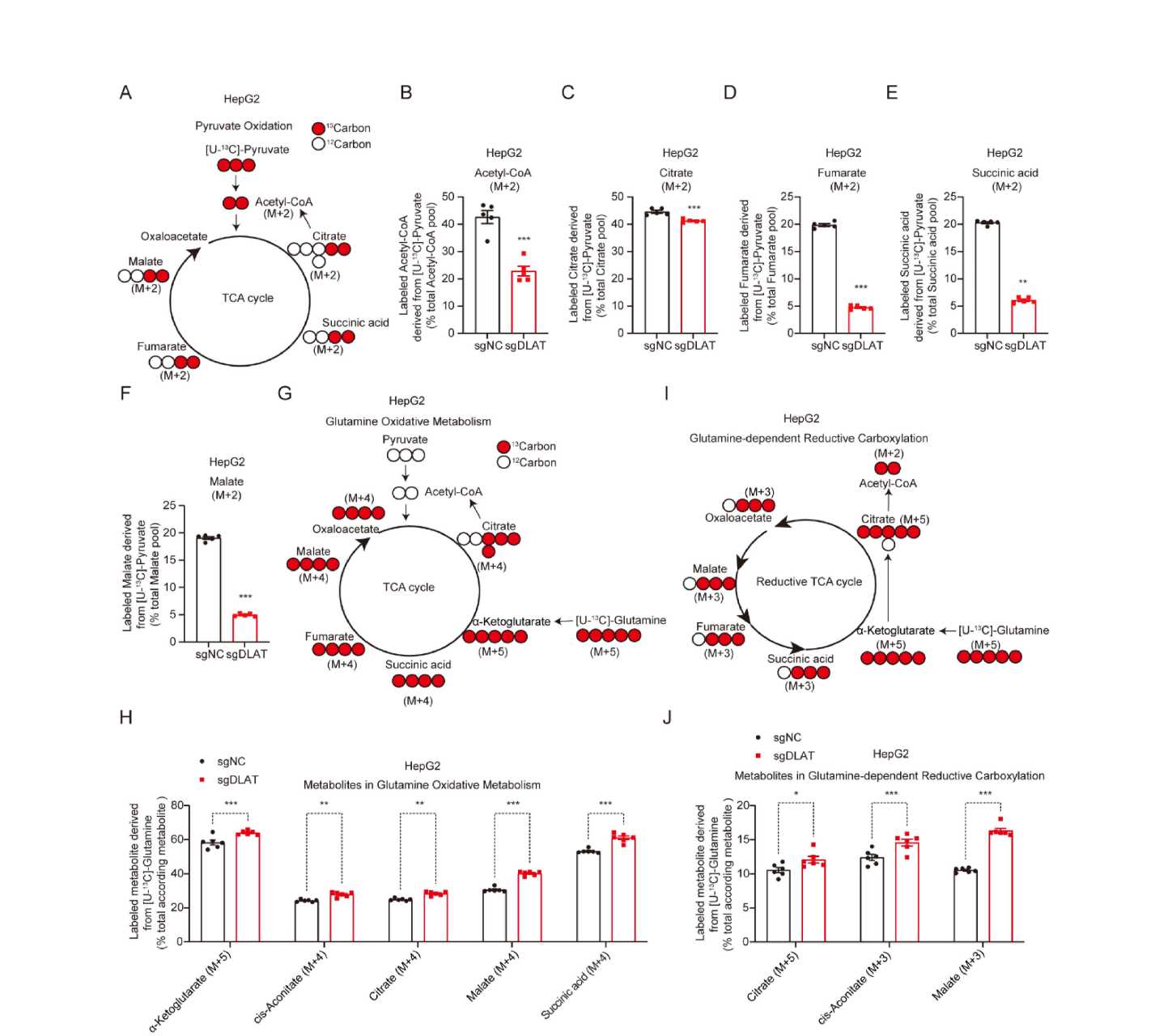
图2. DLAT缺失对TCA循环中间产物的影响有限
3. 靶向DLAT促进HCC患者亮氨酸分解代谢
进一步分析发现,DLAT基因敲除导致细胞中亮氨酸、天冬氨酸和缬氨酸的水平显著降低(图3B)。然而,向Huh7-sgDLAT细胞中分别补充这三种氨基酸时,仅亮氨酸才能有效逆转DLAT缺失导致的细胞生长抑制(图3C-D)。质谱分析证实DLAT缺失细胞中这三种氨基酸含量均下降(图3E)。已有文献数据分析也证实HCC组织亮氨酸水平升高。临床样本分析进一步证实,肝癌组织亮氨酸水平升高且与DLAT的mRNA表达呈显著正相关(图3F),提示亮氨酸代谢在HCC发生发展中可能发挥重要作用。
为阐明DLAT调控亮氨酸代谢的分子机制,作者首先检测了BCAA转运蛋白(如SLC7A5、SLC7A8 和 SLC6A14)的表达和功能。免疫印迹分析显示BCAA氨基酸转运蛋白无明显差异。L-对硼苯丙氨酸荧光示踪(L-paraboronophenylalanine fluorescence tracing)实验表明DLAT缺失对这些氨基酸转运蛋白的功能影响较小(图3G-H)。随后,通过[U-13C]亮氨酸代谢流分析发现,DLAT基因敲除细胞(sgDLAT)亮氨酸分解代谢的下游产物HMG-CoA和乙酰辅酶A水平显著升高,而其上游代谢中间产物4-甲基-2-羰基戊酸(4-Methyl-2-oxovaleric acid,KIC)比例保持不变(图3J-I)。这一结果提示DLAT的缺失主要促进了亮氨酸脱氢后的分解步骤(即支链α-酮酸脱氢酶复合体BCKDH催化的步骤),而非其转氨过程。为进一步探究亮氨酸与HCC预后的关系,通过对BCAA代谢信号TCGA-LIHC数据集进行Kaplan-Meier生存分析发现,支链氨基酸(BCAA)分解代谢通路上调与患者更好的预后显著相关(图3M-N)。
综上所述,本研究结果表明亮氨酸分解代谢主要参与DLAT介导的HCC进展。DLAT通过特异性抑制亮氨酸脱氢后的分解代谢过程,引起亮氨酸的累积,进而引起HCC的发生发展。这一发现为理解HCC的代谢重编程提供了新的理论依据,代谢流技术为这一重大发现提供了重磅技术支撑。
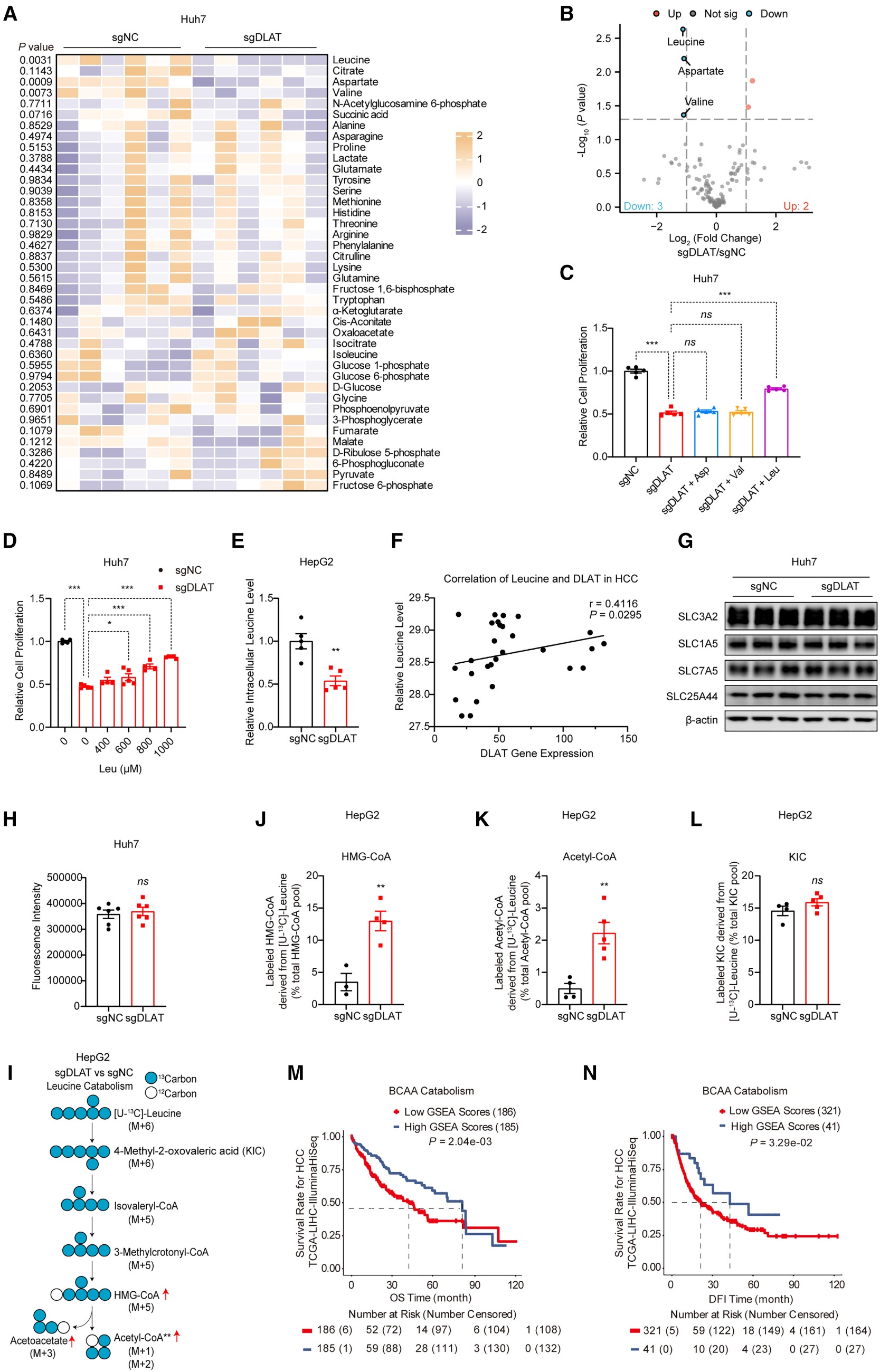
图3. 靶向DLAT可促进HCC患者的亮氨酸分解代谢
4. DLAT敲除抑制亮氨酸-mTOR信号转导进而抑制HCC增殖
DLAT通过维持细胞内亮氨酸水平激活mTORC1信号通路促进肝癌进展。DLAT缺失导致亮氨酸减少,破坏Rag GTPases与Raptor的结合,抑制mTORC1活性及其下游信号分子(p-S6K、p-S6),从而抑制肝癌细胞增殖。补充亮氨酸可逆转这些效应。临床分析显示该通路激活与肝癌患者不良预后相关。DLAT基因的缺失会导致细胞内亮氨酸水平下降,进而抑制mTOR信号通路的活性,最终有效抑制HCC的增殖和进展。
5. DLAT作为乙酰转移酶调控亮氨酸代谢酶AUH的活性发挥作用
DLAT作为乙酰转移酶如何调控亮氨酸的分解代谢呢?首先对HepG2-sgDLAT细胞与对照组(sgNC)进行乙酰化蛋白组学分析,共鉴定出556个显著变化的乙酰化肽段(图4A-B)。KEGG通路富集分析显示,BCAA降解通路是受DLAT缺失影响最显著的通路之一(图4C),提示DLAT可能调控亮氨酸分解代谢酶的乙酰化状态而影响亮氨酸分解代谢。为精准定位DLAT的作用靶点,作者整合分析了三个关键数据集:线粒体蛋白互作质谱数据、DLAT缺失后乙酰化修饰发生变化的蛋白数据集以及BCAA代谢相关酶数据集。分析结果显示,烯酰辅酶A水合酶(AUH)同时出现在三个数据集中,成为DLAT潜在的直接乙酰化靶标(图4D)。后续进行验证实验,免疫沉淀结果显示在Huh7细胞中过表达DLAT显著增强了外源FLag-AUH的乙酰化水平,而敲除DLAT则显著降低了内源AUH的总乙酰化水平(图4E-F)。接着将重组DLAT与AUH蛋白共孵育进行乙酰化测定实验,免疫印迹分析证实DLAT可直接乙酰化AUH(图4G)。酶促反应结果显示,DLAT对AUH具有高亲和力(Km值约为0.6753 mM),并表现出负协同效应(Hill系数约0.7462)。此外,反应速率分析表明该乙酰化反应对AUH浓度具有依赖性(低于0.75 mM时为一级反应,高于1 mM时为零级反应)(图4H)。在固定AUH的浓度时,反应速率随着DLAT浓度的增加而升高(DLAT<15 mM)(图4I)。在机制探索方面,利用分子对接预测了DLAT与AUH的潜在互作界面,免疫荧光共定位实验证实两者主要在线粒体内共存(图4J)。CoIP实验证明了DLAT与AUH之间存在直接的物理相互作用(图4K-M)。
综上所述,DLAT直接与AUH相互作用并调节AUH的乙酰化。
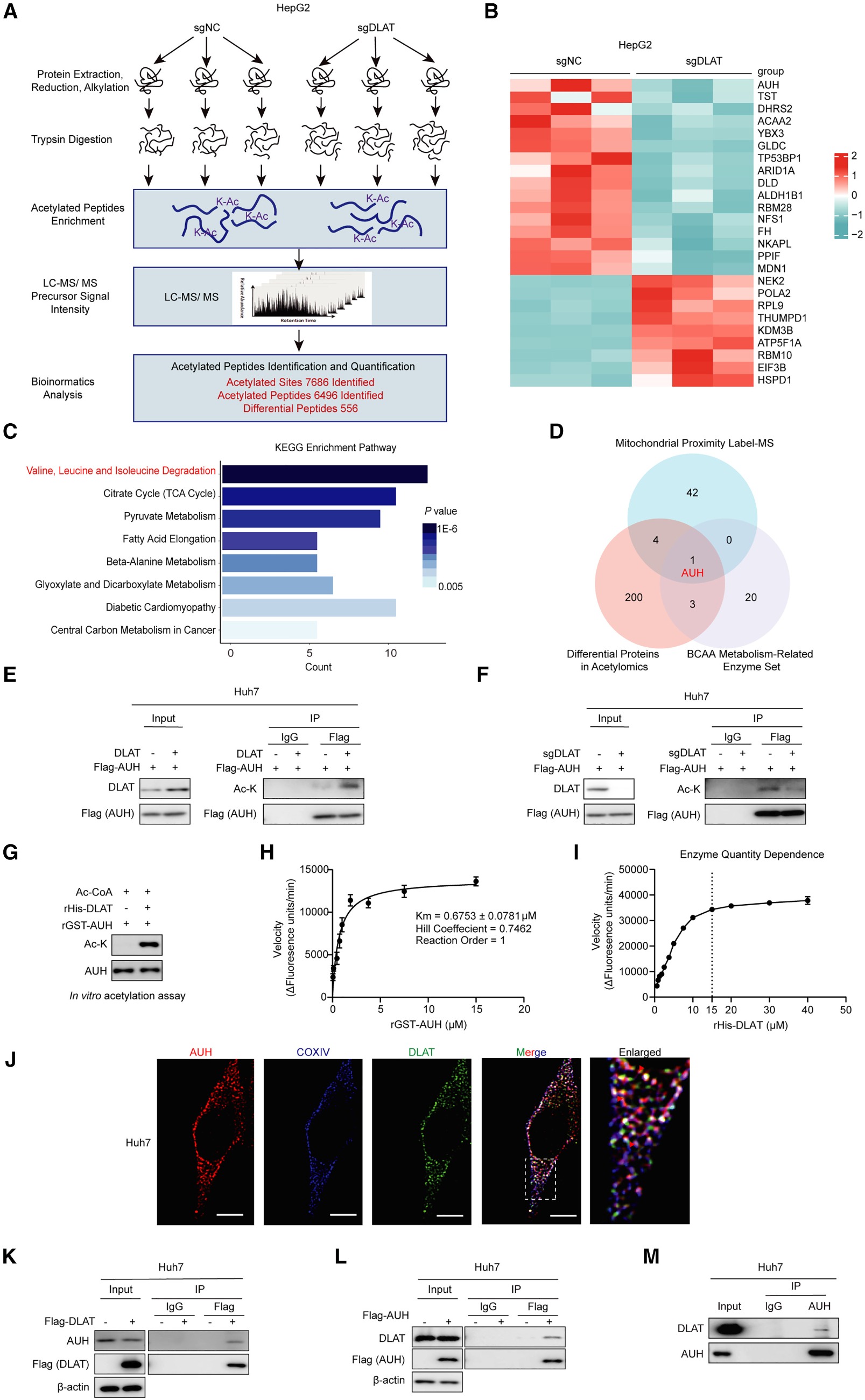
图4.DLAT充当亮氨酸分解代谢酶AUH的乙酰转移酶
6. DLAT介导的AUH-K109位点乙酰化促进HCC进展
在Huh7-sgDLAT细胞中敲低AUH可逆转DLAT缺失导致的细胞生长抑制(图5A),EdU染色证实AUH沉默能缓解DLAT缺失对HCC增殖的抑制作用(图5B-C)。此外,AUH沉默同样减弱DLAT缺失导致的亮氨酸水平下降(图5D),通过再次图5A乙酰化蛋白组学数据,筛选出K109、K160、K211是DLAT潜在乙酰化位点(图5E)。其中,K109R突变对Huh7-sgAUH细胞增殖的抑制最显著(图5F)。为明确DLAT是否直接乙酰化AUH的K109位点,通过体外实验结合质谱分析证实DLAT直接乙酰化AUH的K109位点(图5G),系统发育分析显示,该位点具有跨物种高度保守性,其可能对AUH蛋白的生物学功能具有决定性作用(图5H)。用纯化的野生型AUH蛋白AUHWT和K109位点突变体AUHK109R进行了体外酶活性测定,结果发现AUHK109R突变体相较于AUHWT表现出显著增强的催化活性(图5I),表明K109位点乙酰化抑制AUH酶功能。进一步研究显示,AUHK109R过表达可抑制mTOR通路激活(图5J),转染该突变体的细胞增殖明显受抑(图5K-L)。
综上,DLAT通过直接乙酰化AUH第109位赖氨酸,抑制其作为3-MG-CoA水解酶的催化活性,从而解除AUH对细胞增殖的抑制作用。
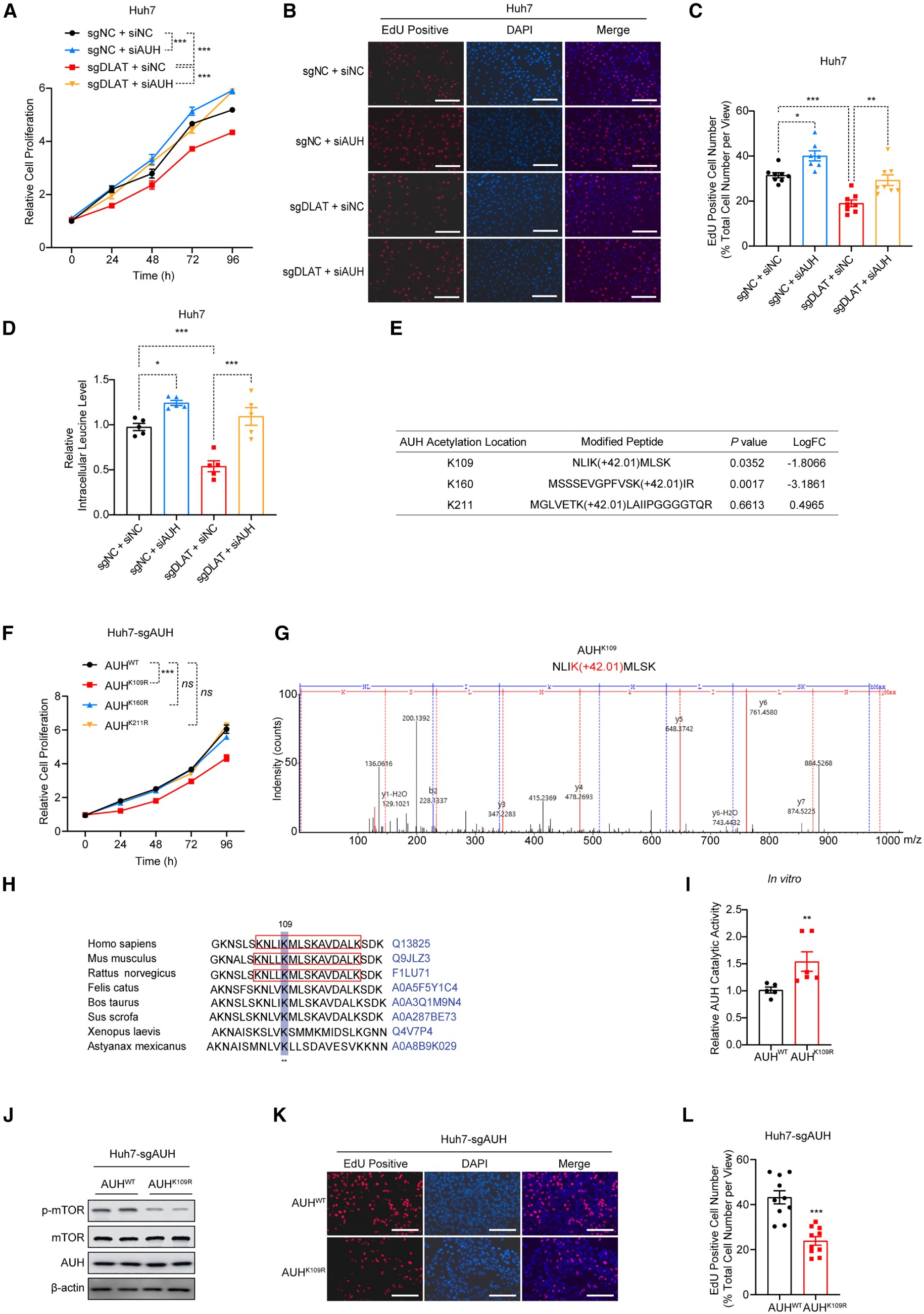
图5. DLAT充当亮氨酸分解代谢酶AUH的乙酰转移酶
7. LNP包装的AUH突变mRNA有效抑制体内肿瘤异种移植物的生长
基于AUHK109R突变体抑制HCC增殖的发现,本研究开发了脂质纳米颗粒(LNP)递送的AUHK109R mRNA的治疗策略。在MHCC-97H异种移植模型中,瘤内注射AUHK109R-mRNA LNP显著抑制肿瘤生长,且不影响小鼠体重。并下调Ki-67、EpCAM表达,降低肿瘤内亮氨酸水平,抑制mTOR通路活化。其抑瘤效果显著优于野生型AUH mRNA LNP,为肝癌靶向治疗提供新途径。
三、结论
本研究系统揭示了丙酮酸脱氢酶复合体(PDH complex)的核心组分DLAT在肝癌发生发展中的双重调控机制及其治疗潜力。DLAT不仅通过其经典的乙酰转移酶活性参与细胞能量代谢调控,更展现出超越传统认知的生物学功能。DLAT缺失虽然未显著改变柠檬酸、顺乌头酸等TCA循环中间产物的水平,但代谢流分析显示其可显著增加谷氨酰胺来源的TCA循环中间产物。值得注意的是,亮氨酸补充能特异性逆转DLAT敲除对肝癌生长的抑制作用,这一现象首次揭示了DLAT在肿瘤代谢重编程中的非经典功能。
与LDHA、ME2和ME1等代谢酶不同,DLAT展现出独特的双重促癌机制:一方面通过丙酮酸代谢酶活性,另一方面通过乙酰化修饰调控AUH活性。质谱分析和酶动力学实验证实,DLAT能以高亲和力特异性乙酰化AUH第109位赖氨酸,显著抑制其催化3-MG-CoA转化为HMG-CoA的限速酶活性。在肝癌组织中,DLAT过表达导致AUH功能持续抑制,引起亮氨酸累积并激活mTOR信号通路,从而驱动肿瘤进展。这一发现不仅填补了BCAA代谢与丙酮酸代谢交叉调控的研究空白,更为理解肿瘤代谢异质性提供了新视角。
基于上述机制,研究团队创新性开发了AUHK109R-mRNA脂质纳米颗粒(LNP)靶向治疗策略。该技术通过LNP递送系统实现AUH K109R突变体的高效表达,在动物模型中显示出显著抗肿瘤效果且无显著毒副作用。与现有mTOR抑制剂相比,这一策略具有独特优势:1)特异性靶向亮氨酸-mTOR信号轴,避免广谱mTOR抑制带来的不良反应;2)可潜在适用于多种DLAT过表达的恶性肿瘤;3)通过恢复生理性亮氨酸代谢平衡实现精准调控。分子对接和免疫共沉淀实验进一步证实,DLAT与AUH存在直接相互作用,为开发特异性小分子抑制剂提供了结构基础。
本研究的重要意义在于:1)首次阐明DLAT通过乙酰化修饰调控亮氨酸代谢的非经典功能;2)建立BCAA分解代谢障碍与肝癌进展的直接因果关系;3)开发具有转化潜力的精准治疗新策略。这些发现不仅拓展了对肿瘤代谢重编程的认知,也为发展基于代谢调控的癌症治疗提供了新思路。未来研究将进一步优化LNP递送系统,探索其在其他恶性肿瘤中的应用价值,并开发靶向DLAT-AUH相互作用的小分子抑制剂,为临床治疗提供更多选择。
谱领生物
代谢流是连接基因和表型的重要桥梁,其能够通过定量描绘代谢物在复杂网络中的实时流动,揭示代谢重编程的本质,为发现新的治疗靶点、阐明耐药机制等提供强大的技术支持和理论依据。
代谢流具体能为我们做什么呢?
1.绘制代谢流动态地图:在本研究通过[U-13C]丙酮酸和[U-13C]谷氨酰胺代谢流分析具体量化DLAT缺失对TCA循环中间产物的影响(中间产物总量不变),表明HCC通过增强谷氨酰胺的分解代谢补偿丙酮酸代谢,维持TCA循环。
2.精准预测作用靶点,驱动精准治疗:在本研究中使用[U-13C]亮氨酸示踪亮氨酸分解途径,DLAT的缺失增加13C标记的HMG-CoA和乙酰辅酶A(亮氨酸分解产物)精确定位DLAT抑制AUH催化的亮氨酸→HMG-CoA步骤,为治疗肝癌提供了潜在靶点。
如果您的研究涉及代谢领域,可以添加下方谱领代谢售前服务咨询!





