Nat Metab丨氧化鸟氨酸代谢支持非炎症性艰难梭菌的肠道无症状携带
艰难梭菌(Clostridioides difficile, Cd)是一种毒素介导的感染的主要肠道病原菌,它造成美国每年超过20万例住院和1.3万例死亡。Cd长期以无症状携带方式持续定殖于人类肠道,并且可能是传播Cd感染的储存库。因此,阐明Cd在无疾病状态下持续存在的分子机制对于理解发病机制和制定精细的治疗策略是十分必要的。该项工作通过肠道菌群宏转录组学分析,发现对Cd感染和炎症抵抗的小鼠表现出菌群水平精氨酸和鸟氨酸代谢途径的高表达。为了弄清楚Cd代谢,该研究对两种野生型Cd菌株(630和R20291)及其同基因毒素缺陷突变株感染的悉生小鼠肠道菌群进行RNA测序,发现编码氧化鸟氨酸降解的单操纵子在非产毒Cd菌株中始终上调。进一步采用基于GC-MS的非靶向代谢组学和基于LC-MS的靶向代谢组学技术,并与细菌和宿主遗传学相结合,证明膳食和宿主来源的鸟氨酸为Cd定殖提供了竞争优势,提示Cd在非炎症的健康肠道内持续存在的机制。

肠道病原菌艰难梭菌(Cd)是一种导致肠道感染的梭状芽孢杆菌,主要通过分泌大量糖基化毒素蛋白而引起疾病,它是世界范围导致医院腹泻的主要原因。在易感宿主中,感染可导致中毒性巨结肠或死亡。Cd长期以无症状携带方式持续定殖于人类肠道,如高达71%婴儿和15%健康成人可能无症状携带毒性Cd菌株。无症状携带可能是传播Cd感染的重要储存库。因此,阐明Cd无症状携带的分子机制对于理解发病机制和制定精细的治疗策略是十分必要的。更好地了解非炎症(稳态)与炎症(由毒素产生)条件下的Cd代谢行为将更好地为解决和预防疾病进展提供信息。
1. 鸟氨酸氧化降解代谢在非炎症Cd感染组高表达
首先对腹泻病人提供的粪便样本进行菌群测序,根据症状和微生物组成,分为外表健康(healthy-like)样本和菌群失调类样本。然后建立临床相关小鼠模型。对来自于healthy-like粪便样本定殖小鼠(外表健康人源化小鼠)和菌落失调供体粪便样本定殖小鼠(菌群失调人源化小鼠)的盲肠菌群宏转录组通路表达数目进行比较,发现数百条通路发生了显著变化(菌群失调人源化小鼠富集到82个途径,外表健康人源化小鼠富集到219个途径),其中外表健康人源化小鼠富集到28条与氨基酸代谢相关途径,而菌群失调人源化小鼠仅富集到6个氨基酸代谢途径。外表健康人源化小鼠的肠道菌群水平上与精氨酸、鸟氨酸和多胺代谢相关的几条途径高表达(图1b)。这些相互关联的代谢途径是令人感兴趣的,因为精氨酸和鸟氨酸代谢为多胺,通过增加紧密连接蛋白的表达来增强肠道屏障功能,减少免疫细胞的炎症反应。用艰难梭菌(Cd)感染healthy-like人源化小鼠,发现其中6条菌群氨基酸代谢相关通路仍保持高表达(图1c)。然而,Cd感染的菌群失调人源化小鼠的肠道菌群中未富集到精氨酸、鸟氨酸和多胺代谢相关通路(图1c)。这些结果说明,菌群氨基酸代谢在增强宿主屏障功能方面具有潜力,并在受到Cd攻击时维持肠道处于非炎症状态方面发挥作用。
随后,研究人员采用同基因突变株即毒素拥有Cd(630 WT)或毒素缺乏Cd(630 Tox-)感染悉生小鼠(gnotobiotic mice)。630 WT诱导的病理学特征显著多于630 Tox-定殖小鼠(与未感染的对照组无差异)。比较630 WT与R20291(产生第三种毒素的超毒力菌株),发现R20291 WT比630 WT诱导更大的整体组织损伤(图2a)和更多的炎性细胞浸润(图2b)。WT Cd感染获得比毒素缺乏Cd感染更高的Cd相对丰度(扩展图1b)。因此,Cd产生的毒素对宿主造成更严重的组织损伤、炎症并赋予Cd体内竞争优势。
接下来对感染R20291WT、R20291 Tox-或未感染的对照小鼠的盲肠内容物进行非靶向代谢组学分析。肠腔代谢物可以对产毒素Cd感染组(WT)、毒素缺乏Cd感染组(Tox-)或未感染组(Ctrl)这三组进行区分(扩展图1c)。几种氨基酸及其细菌代谢产物如鸟氨酸(Ornithine)、腐胺(Putrescine,微生物鸟氨酸代谢的一种产物)和瓜氨酸(Citrulline,潜在的前体)在感染后发生了显著改变(扩展图2a,2b)。5-氨基戊酸是鸟氨酸和/或脯氨酸的一种还原产物,在无毒素诱导炎症组(Tox-)更高(扩展图2b)。代谢组学数据结合易感或抗性人源化小鼠的菌群水平转录途径分析表明,在没有Cd感染诱导炎症条件下(即Tox-感染或未感染),精氨酸、鸟氨酸和腐胺代谢途径更具活性。
为了检测Cd本身的代谢行为,研究人员对感染WT(630或R20291)、Tox− (630或R20291) 或未感染的对照组小鼠5天的盲肠内容物进行RNA-Seq分析。R20291与630相比产生更多的毒素,引起更大程度组织损伤(图2a)和增加的炎性细胞浸润(图2b),表现出比630更大程度的差异基因表达(图2c)。毒素缺乏Cd感染(Tox-)比产毒素Cd感染表达更高的氧化性L-鸟氨酸降解途径(图2e),表明该途径支持非炎症肠道中的Cd代谢。【无炎症Cd感染的肠道菌群RNA-Seq分析表明氧化性L-鸟氨酸降解途径高表达】
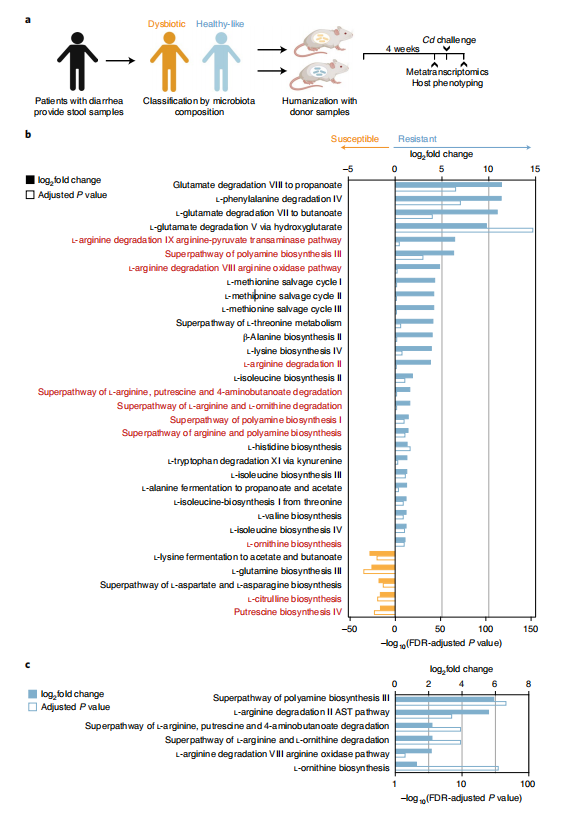
图1 CDI易感宿主的群落氨基酸代谢途径不同
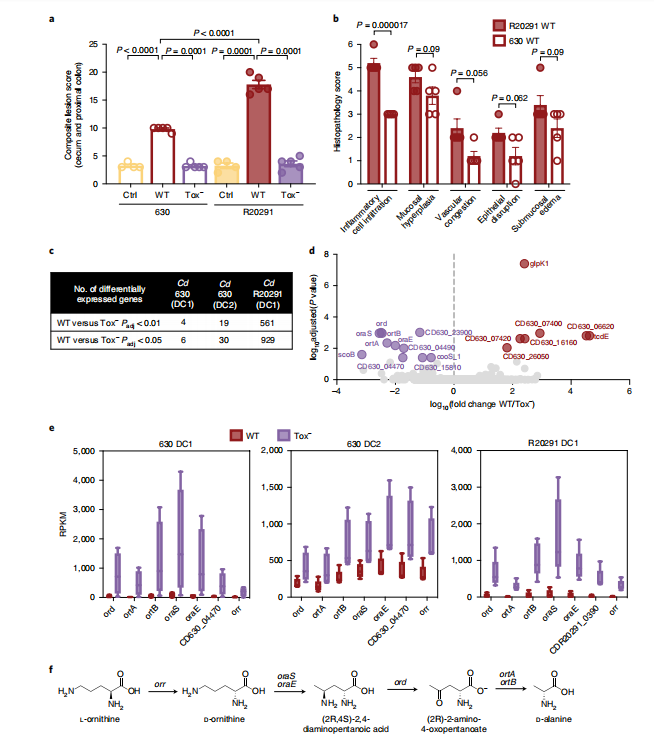
图2 假定的 l-鸟氨酸氧化降解位点在非炎症环境中 Cd 代谢的无菌模型中始终存在差异表达
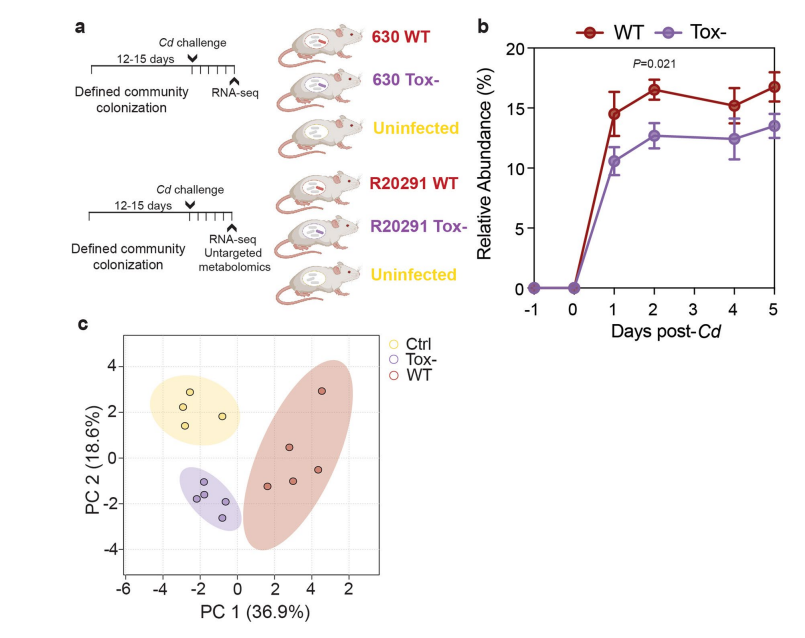
扩展数据图1 Cd 毒素产生在体内具有优势并产生独特的代谢组
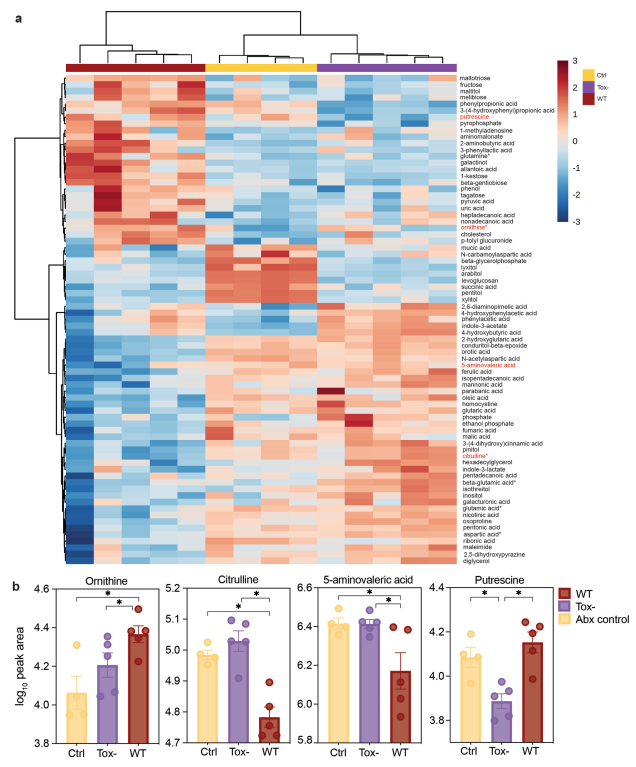
扩展数据图2 非靶向代谢组学显示肠腔内代谢物的毒素依赖性变化
2. 鸟氨酸的膳食来源
外源补加L-鸟氨酸增加了体外培养的艰难梭菌(Cd)R20291和630生长量(扩展图3b,c)。在氨基酸基本培养基中,与野生型Cd(WT Cd)相比,鸟氨酸氧化降解缺失突变株∆oraSE和来自于精氨酸/瓜氨酸合成鸟氨酸的缺失突变株∆argF在24h后遭受竞争劣势 ,但是参与谷氨酰胺/谷氨酸和鸟氨酸相互转化的∆argM缺失突变株却没有改变(扩展图3a,3d)。对于增加菌体生长密度来说,鸟氨酸氧化降解和来自于精氨酸/瓜氨酸的鸟氨酸生物合成比来自于谷氨酰胺/谷氨酸的鸟氨酸生物合成更为重要。外源添加鸟氨酸增加了WT对∆oraSE的优势,而精氨酸则没有影响(扩展图3e),表明从环境摄取鸟氨酸具有潜在适应性优势,而不是来自Cd自身代谢。在丰富培养基中,WT和∆oraSE组Cd生长量达到相同的最大光密度,补加L-鸟氨酸可促进WT而不是∆oraSE的生长(扩展图3f)。采用含WT或∆oraSE的一组特定细菌感染悉生小鼠,发现鸟氨酸氨基变位酶(ornithine aminomutase)缺失突变株上调表达鸟氨酸氧化降解相关基因(orr,ord和ortB),而鸟氨酸还原途径(cyclodeaminase、prdF和prdD)以及参与鸟氨酸与瓜氨酸/精氨酸(argF)或谷氨酸/谷氨酰胺(argM)相互转化的基因不受影响(扩展图3g),说明鸟氨酸氨基变位酶缺失影响体内鸟氨酸氧化代谢途径。
研究者比较了标准啮齿动物膳食(含有鸟氨酸)或鸟氨酸缺乏膳食喂养的WT Cd定殖小鼠的转录谱,发现氧化鸟氨酸降解相关基因是不同膳食条件之间的最大差异基因。当膳食存在鸟氨酸时,参与鸟氨酸氧化代谢的基因表达更高(图3a)。为了确定鸟氨酸降解是否赋予Cd体内适应性优势,将常规肠道菌群定殖小鼠与等量WT Cd和∆oraSE Cd共感染。当饲喂常规小鼠标准饮食(含鸟氨酸)时,鸟氨酸降解赋予WT Cd的宿主体内适应性优势胜过∆oraSE突变株,而完全不含鸟氨酸的膳食则无差异(图3b)。当饲喂不含鸟氨酸膳食时,如果提供含1%(w/v)L-鸟氨酸的饮水,WT Cd展现了针对∆oraSE的竞争优势;当缺乏膳食鸟氨酸时,WT Cd小鼠没有胜过∆ oraSE Cd(图3c),说明鸟氨酸本身提供WT Cd超过∆oraSE Cd的竞争优势。因此,膳食鸟氨酸影响Cd代谢。
当给WT或∆oraSE Cd感染的悉生小鼠饲喂无鸟氨酸饮食并补充含鸟氨酸饮用水后,WT感染小鼠比∆oraSE感染小鼠获得显著更高丰度的Cd定殖(图3d)。对于复杂菌群常规小鼠,当喂食无鸟氨酸饮食并补充含鸟氨酸的饮用水后,盲肠内容物获得更高的总Cd丰度(扩展图4a)。当饲喂标准饮食并提供含鸟氨酸饮用水后,WT组粪便(扩展数据图4b)和盲肠内容物(扩展数据图4c)获得更高的Cd定殖绝对丰度。说明膳食鸟氨酸促进了Cd的定殖水平。
对于悉生小鼠和常规小鼠,∆oraSE Cd感染后的丰度虽然显著低于WT(图3d),但是其诱导的血清脂质运载蛋白-2(宿主炎症指标)水平却显著高于WT组(图3e, 3f),但毒素含量无显著差异(扩展图4d)。膳食鸟氨酸补充剂本身不改变血清脂质运载蛋白-2(扩展图4e)。数据表明∆oraSE Cd菌株本身代谢引起宿主炎症反应,而WT Cd的正常代谢鸟氨酸的能力导致较少炎症。因此,Cd鸟氨酸代谢有助于改善宿主炎症状态。
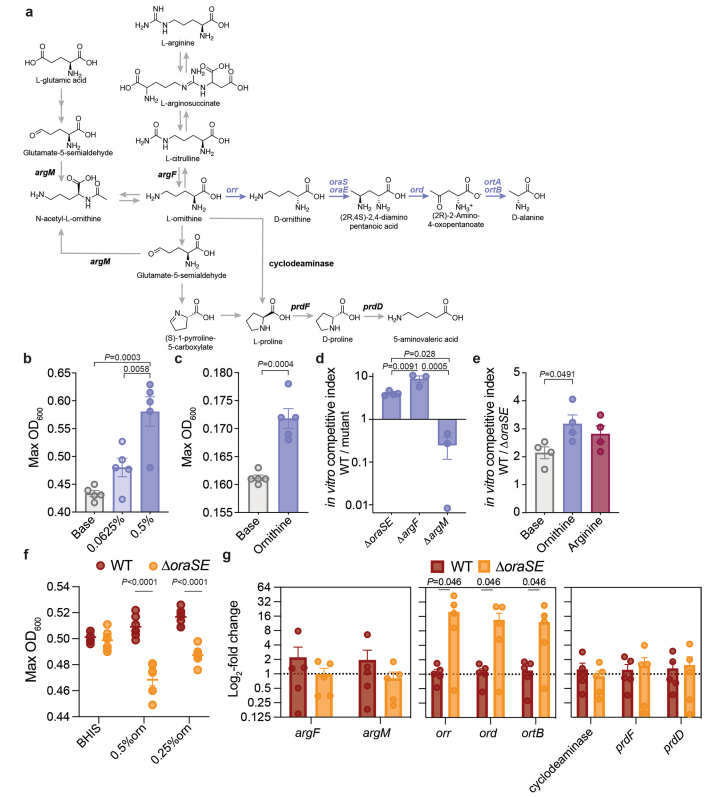
扩展数据图3 Cd鸟氨酸降解和生物合成途径
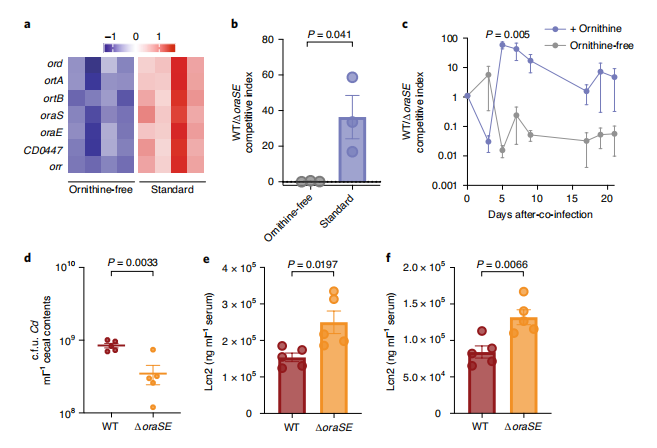
图3 饮食中鸟氨酸的代谢对Cd具有竞争优势,并可减少宿主炎症。
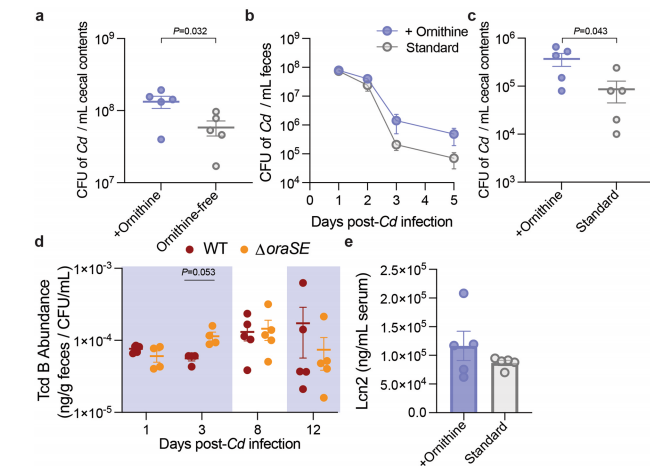
扩展数据图4 膳食鸟氨酸可提高小鼠肠道中的Cd丰度
3. 鸟氨酸的宿主来源
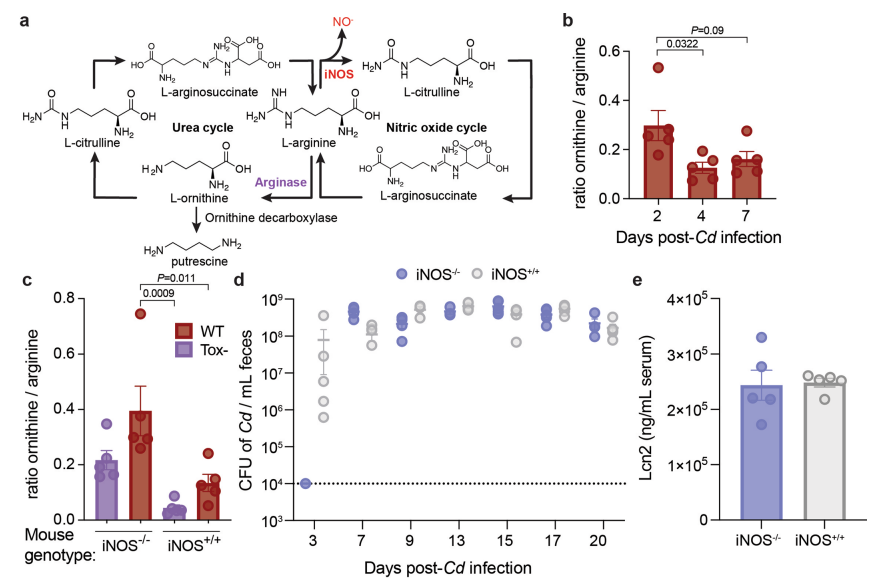
鸟氨酸在哺乳动物免疫代谢中起重要作用。精氨酸酶将精氨酸分解成鸟氨酸,鸟氨酸是亚精胺,精胺和腐胺等多胺类物质的前体(扩展图5a)。作者假设,当没有毒素诱导的炎症(Tox−)时,Cd可利用宿主来源的鸟氨酸。为了确定宿主可诱导的一氧化氮合酶(iNOS)或精氨酸酶是否对Cd感染有反应,我们对常规小鼠进行标准抗生素预处理(每只小鼠灌胃1 mg克林霉素)和随后的WT Cd感染。与未感染的抗生素处理对照组相比,WT Cd感染小鼠遭受显著更高的组织损伤和炎性细胞浸润(图4a)。一氧化氮合酶(iNOS)也利用精氨酸作为活性氧爆发期间NO−产生的底物。精氨酸酶活性被描述为2型炎症反应标志,特别是巨噬细胞。WT Cd感染引起小鼠结肠组织Nos2(一氧化氮合成酶2基因)上调表达,而Arg1(精氨酸酶1基因)没有显著改变(图4b),表明更少的精氨酸可用于鸟氨酸的生物合成。因此,Cd毒素诱导的宿主炎症抑制了精氨酸经宿主精氨酸酶转化为鸟氨酸。
为了增加宿主精氨酸以用于经宿主精氨酸酶的鸟氨酸生物合成,我们感染了Nos2基因敲除小鼠(iNOS−/−)。Cd感染期间,iNOS−/−小鼠粪便鸟氨酸与精氨酸的比值较iNOS+/+小鼠升高(扩展图5c),且iNOS−/−小鼠粪便鸟氨酸浓度较iNOS+/+小鼠显著升高(图4c)。为了解开宿主iNOS和Cd氧化鸟氨酸途径之间的代谢相互作用,研究者向无鸟氨酸饮食中加入等量WT和∆oraSE Cd对iNOS−/−和iNOS+/+小鼠进行共感染。与研究者假设的Cd利用宿主来源的鸟氨酸一致,WT Cd感染比∆oraSE Cd感染的iNOS−/−小鼠具有显著的竞争优势,而不是iNOS+/+小鼠(图4e)。Nos2基因型小鼠不影响Cd初始定殖后的丰度变化(扩展图5d)和全身炎症(扩展图5e)。因此,通过iNOS消融增加宿主的鸟氨酸产量,引起Cd氧化鸟氨酸相关基因的表达增加,并提供WT Cd竞争优势。
随后,为了确定膳食鸟氨酸的可用性是否影响Cd代谢,研究人员比较了用WT Cd喂养标准啮齿动物饮食(含有鸟氨酸)或完全定义的缺乏鸟氨酸的饮食的小鼠的转录谱。氧化鸟氨酸降解基因座中的基因在饮食条件之间表达差异最大:当存在饮食鸟氨酸时,参与其氧化代谢的基因表达更高。研究人员使用WT或鸟氨酸氧化降解(ΔoraSE)Cd感染常规微生物群定植的小鼠,发现补充膳食鸟氨酸可赋予Cd竞争优势。
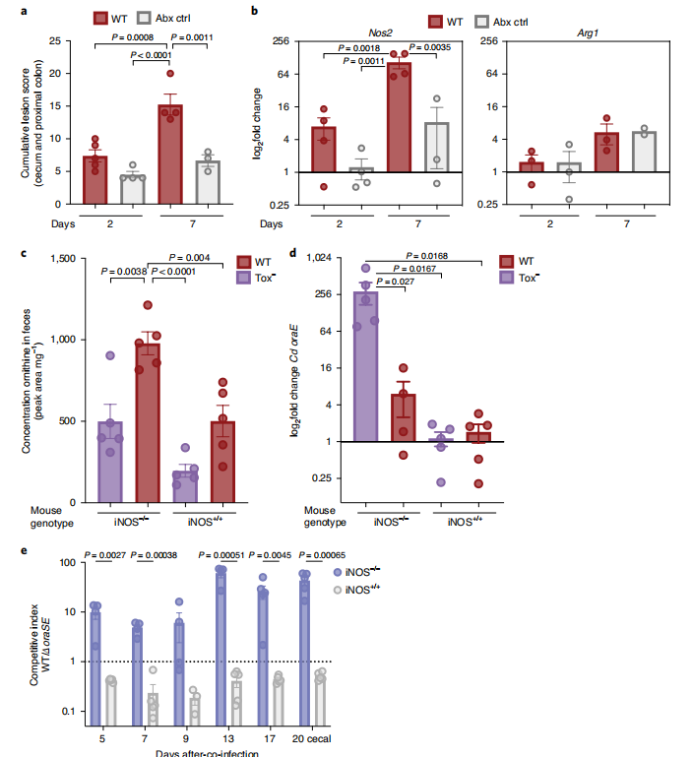
图4 通过宿主iNOS缺乏产生的鸟氨酸为肠腔中的Cd提供了竞争优势
扩展数据图5 通过诱导型一氧化氮合酶进行宿主鸟氨酸代谢
该项工作研究了在没有疾病症状和共生肠道菌群存在下的艰难梭菌(Cd)的持续存在性。虽然我们清楚肠道病原体受益于其毒力因子带来的生理变化,但是尚不清楚Cd的无症状携带机制。该项工作采用代谢组学与宏转录组学相结合的方法,发现对Cd感染和炎症抵抗小鼠(无症状携带)表现出菌群水平精氨酸和鸟氨酸代谢途径的高表达。由于膳食鸟氨酸或宿主产生的鸟氨酸的存在,Cd氧化降解鸟氨酸的能力具有竞争优势。这项工作强调了在肠道内稳态条件下宿主免疫代谢和Cd之间的代谢相互作用。了解病原体在没有疾病的情况下的持久性是迈向预防性治疗策略的重要一步。
Pruss KM, Enam F, Battaglioli E, DeFeo M, Diaz OR, Higginbottom SK, Fischer CR, Hryckowian AJ, Van Treuren W, Dodd D, Kashyap P, Sonnenburg JL. Oxidative ornithine metabolism supports non-inflammatory C. difficile colonization. Nat Metab. 2022 Jan;4(1):19-28.




