Sirtuin 5通过脱戊二酰依赖的方式促进谷氨酰胺分解进而参与结直肠癌的发生

研究背景
肿瘤的异常代谢特征被认为是癌症的一个标志,并已成为新的治疗策略的一个有吸引力的靶点。结直肠癌(CRC)是全球第三大最常见的恶性肿瘤,也是癌症相关死亡的第四大原因。结直肠癌(CRC)在肿瘤发生过程中也表现出不受调控的代谢特征。今天小编就和大家一起来探究一下结直肠癌到底是如何发生的呢?
前言
有研究表明代谢酶可以被许多蛋白质翻译后修饰(PTMs)所调控,包括乙酰化、琥珀酰化、丙二酰化、戊二酰化、甲基化、丙酰化、丁酰化和巴豆酰化。
而Sirtuin5(SIRT5)作为sirtuin家族的一员,是赖氨酸琥珀酰化、丙二酰化和戊二酰化的全球调节因子,它显示出低或不可检测的脱乙酰活性。这三种新的ptm被归类为短链赖氨酸酰化反应,它们类似于赖氨酸乙酰化反应,但在疏水性、电荷或碳氢链长度方面不同。异柠檬酸脱氢酶2(IDH2)的脱羧作用和SITR5葡萄糖-6-磷酸脱氢酶的脱戊化作用导致细胞活性氧水平降低,从而保护细胞免受氧化损伤。SIRT5靶点活性的改变,如丙酮酸脱氢酶复合物和琥珀酸脱氢酶,都与癌细胞代谢失调有关。
作者首先通过大规模的蛋白质组分析来确定SIRT5的各种代谢靶点,但是关于SIRT5在恶性肿瘤中调节的整体代谢变化的研究很少。于是选择通过高通量气相色谱-质谱(GC-MS)筛选和基于13C的代谢通量分析,确定谷氨酰胺依赖的三羧酸(TCA)循环回补是SIRT5调控大肠癌细胞的主要代谢途径。还揭示了SIRT5对GLUD1脱戊酰化和功能激活的调节作用。表明SIRT5是大肠癌潜在的治疗靶点。
研究方法
本文采用非靶向代谢组学分析,代谢流分析,RNA干扰技术,流式细胞术分析,蛋白印迹法,细胞增殖和克隆形成分析,定量实时逆转录聚合酶链反应,免疫荧光法等研究方法。这里小编给大家着重介绍一下其中的非靶向代谢组学分析及代谢流分析。
代谢组学分析
由于SIRT5对肿瘤发生的促进作用依赖于其催化活性,这种催化活性可能调节细胞代谢,为了确定SIRT5是否对CRC代谢重编程有影响。作者在SIRT5已经被沉默的HCT116细胞中提取代谢物进行GC-MS分析。如图1a所示,在进行偏最小二乘判别分析(PLS-DA)时,可以观察到对照细胞和SIRT5 siRNAtransfected细胞之间的分布模式对比。
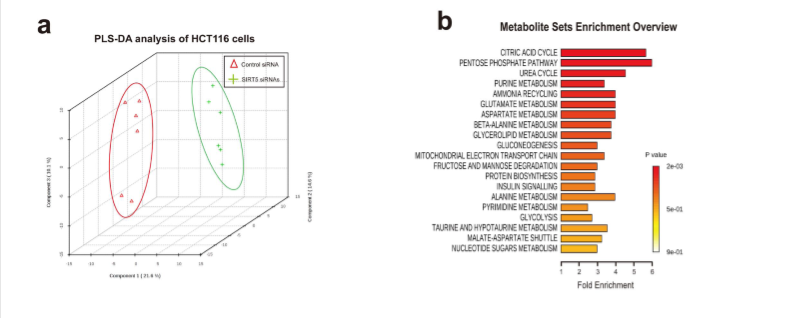
图1
差异丰富代谢物的代谢物集富集分析显示,SIRT5下调导致TCA循环和谷氨酰胺代谢发生深刻变化(图1b),包括谷氨酸丰度增加和α-酮戊二酸(α-KG)水平降低。
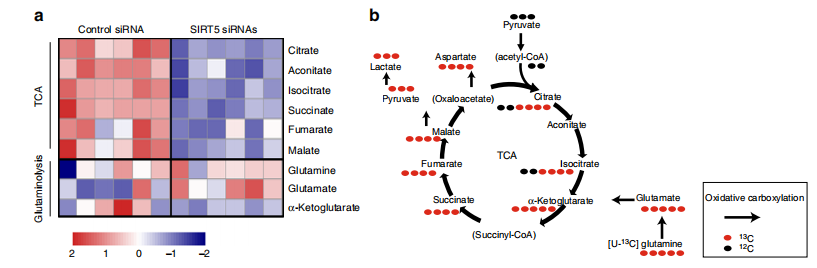
图2
伴随着几乎所有TCA循环中间产物的急剧减少(图2a)。如图2b所示,谷氨酰胺被代谢为α-KG,它提供碳的临界入口点,为TCA循环提供燃料,并支持癌症中的合成代谢过程。这些结果使我们假设SIRT5可能在调节肿瘤谷氨酰胺代谢中起作用,从而影响TCA循环代谢产物的丰度。
为了确定SIRT5是否影响谷氨酰胺摄取,我们测量了SIRT5沉默后细胞培养液中谷氨酰胺的含量。
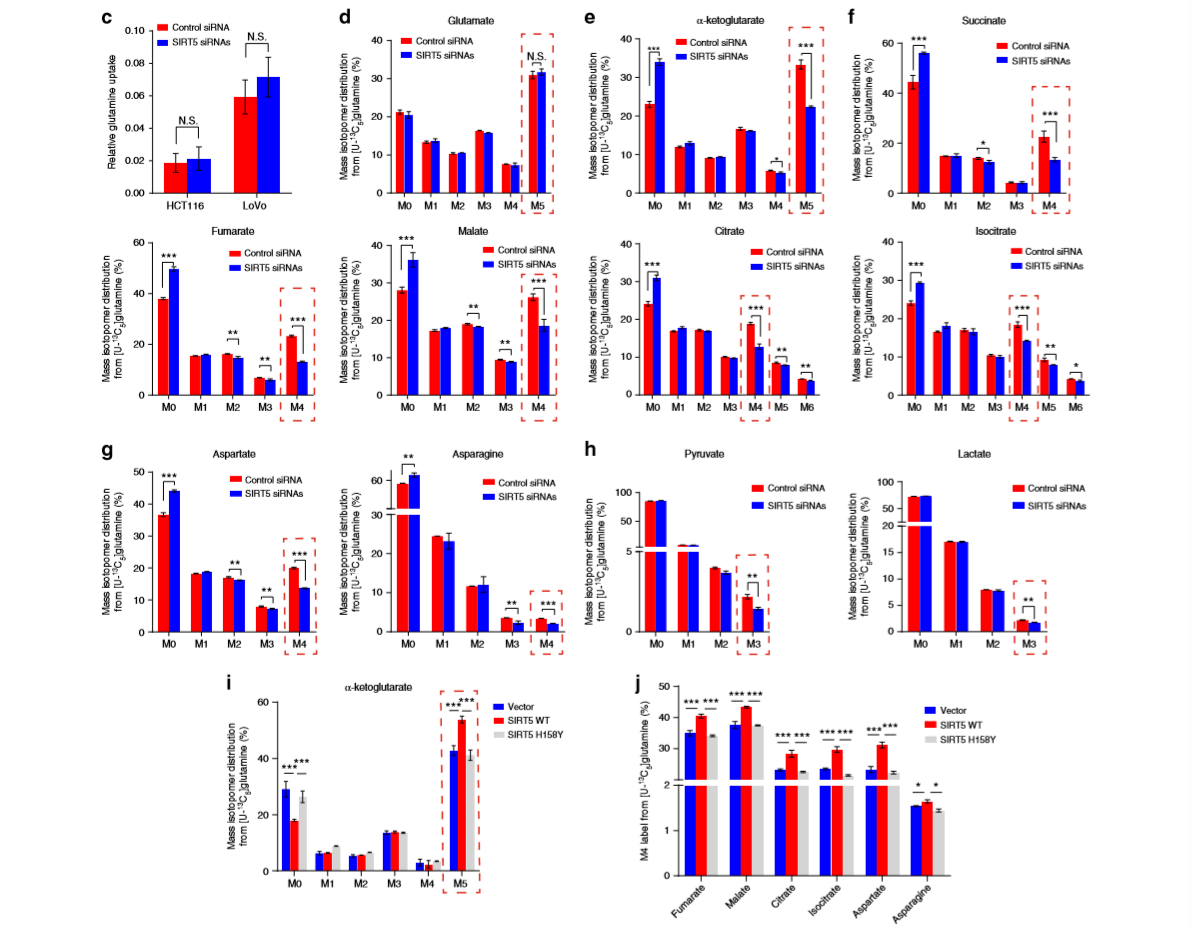
图3
在HCT116和LoVo细胞系中,谷氨酰胺的消耗量保持相对恒定(图3c)。然后确定谷氨酰胺转换是否改变。用均匀的13C标记谷氨酰胺([U-13C5]谷氨酰胺)监测SIRT5沉默后谷氨酰胺进入TCA循环中间产物的情况。监测发现在24小时时,达到代谢和同位素稳定状态。
为了排除细胞生长引起的代谢变化,在随后的实验中使用LoVo细胞系,因为在该细胞系中,SIRT5缺失在SIRT5敲除后的24小时不抑制细胞增殖。结果显示,并不影响[U-13C5]谷氨酰胺并入谷氨酸(图3d);但是,它显著降低了α-KG(m+5),这表明谷氨酸水平的升高不是由合成增强引起的,而是由于α-KG转化率降低。
如图3f所示,在SIRT5沉默时,琥珀酸(m+4)、富马酸(m+4)、苹果酸(m+4)、柠檬酸(m+4)和异柠檬酸(m+4)的部分被抑制。除了TCA循环中间产物外,我们还观察到谷氨酰胺对天门冬氨酸和天门冬酰胺的贡献显著降低,天门冬氨酸和天门冬酰胺是主要通过TCA循环从谷氨酰胺中衍生的非必需氨基酸(NEAA)(图3g)。
作者又进一步测试了谷氨酰胺衍生丙酮酸和乳酸的水平。如图3h所示,虽然丙酮酸和乳酸的一小部分来自谷氨酰胺(<5%),但抑制SIRT5导致丙酮酸(m+3)和乳酸(m+3)轻微但显著减少。
在LoVo细胞中观察发现SIRT5的过度表达显著增加了m+5α-KG的比例(图3i),并促进了[U-13C5]谷氨酰胺在m+4标记的TCA循环中间产物中的较高掺入率,同时伴有谷氨酰胺衍生的天门冬氨酸和天门冬酰胺(图3j)。然而,酶缺陷突变体并没有表现出所有这些功能,这表明SIRT5的催化活性是促进谷氨酸转化为α-KG所必需的。
为了准确监测还原性谷氨酰胺代谢,我们使用[1-13C]谷氨酰胺进行了代谢通量分析,该谷氨酰胺仅通过还原性羧化途径将碳转移到柠檬酸盐。虽然观察到α-KG(m+1)的显著变化,但SIRT5的敲除和过度表达均未改变来源于谷氨酰胺的标记m+1苹果酸、富马酸和天冬氨酸的水平。因此,我们证明SIRT5主要调节CRC细胞的氧化谷氨酰胺代谢,但对还原羧基化途径没有明显的影响。
综上所述,这些结果支持这样的观点,即SIRT5以去乙酰化介导的方式提高CRC细胞的谷氨酰胺利用率,从而增加TCA循环中碳的补充,并可能导致SIRT5诱导的CRC增殖。
之后,作者又用稳定表达控制载体SIRT5-WT和SIRT5-H158Y的HCT116细胞在裸鼠体内建立了异种移植瘤模型,评估肿瘤生长情况,实验结束时,对异种移植瘤组织切片进行GLUD1酶活性分析。SIRT5-WT的过度表达显著加速了结直肠癌的发生。
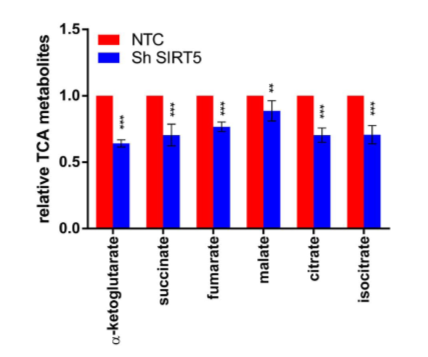
图4
此外,作者发现当GLUD1在SIRT5-高表达肿瘤中被抑制时,异种移植研究显示肿瘤生长延迟,肿瘤大小和质量降低,这表明GLUD1基因敲除显著抑制了SIRT5诱导的肿瘤生长。相反,SIRT5基因敲除异种移植物小鼠的结直肠癌发生率降低,肿瘤体积和重量降低。对肿瘤裂解物的GC-MS分析还显示,SIRT5沉默导致TCA循环代谢物显著下调,包括α-KG、琥珀酸、富马酸、苹果酸、柠檬酸和异柠檬酸(图4)。因此,得出SIRT5通过激活GLUD1进而增强TCA循环流量而导致CRC恶性表型的模型。
结论
癌症代谢的一个共同特点是能够获得和利用营养物质以满足快速增殖的需要。在这项研究中,作者证明了SIRT5在结直肠癌代谢重编程中的关键作用,发现SIRT5的过度表达通过以脱戊酰化依赖的方式激活GLUD1促进谷氨酰胺合成代谢,并与CRC细胞增殖、存活和异种移植瘤生长相关。
谷氨酰胺代谢增强促进恶性细胞大分子生物合成。在本研究中,作者证明谷氨酰胺代谢在结直肠癌的翻译后水平上受SIRT5调控。研究结果表明,SIRT5沉默阻止了谷氨酸形成α-KG,进而抑制谷氨酰胺衍生代谢产物进入TCA循环,从而减少合成代谢的前体。显示SIRT5是一种肿瘤谷氨酸分解的调节因子,通过其以去谷氨酸依赖的方式激活GLUD1,提示SIRT5是一种有前途的选择性杀伤癌细胞的抗结直肠癌靶点。这些发现支持SIRT5的致癌作用,使其成为一个可能的结直肠癌生物标志物。




