应用代谢组学和蛋白组学相结合的方法研究血管抑郁的小鼠模型
研究背景
抑郁症是现代社会常见的心理健康问题,其症状主要表现为对周围活动的悲伤和失去兴趣或乐趣。患者经常会有负罪感,自卑,睡眠质量差,食欲不振,疲劳,注意力减少,有时还会自杀。血管性抑郁症(VD)是抑郁症的一种亚型,是由血管疾病或脑血管危险因素引起的。近年来,VD患者的比例明显增加,严重影响了患者的生活质量。然而,目前VD的发病机制尚未完全了解,基础研究也不充分。
研究方法
在本研究中,作者以LC−MS为基础的蛋白质组学和代谢组学相结合的方法,研究小鼠VD模型中的蛋白质以及代谢的调控网络。使用代谢组学和蛋白质组学分析结合ITRAQ方法在VD小鼠的海马样品中检测到44种差异代谢物和304差异蛋白。通过关联和整合分析构建了一个蛋白-代谢调控网络。然后定量地验证了生物信息学分析中显示的双分子的水平,使用LC−MS/MS和Western blotting验证结果表明了神经可塑性、神经递质运输、神经元细胞的调节发生了变化,增殖和凋亡,氨基酸,脂质和能量代谢紊乱。参与这些途径的蛋白质和代谢物将为研究VD的机制提供一个更有针对性和可信的方向。因此,本文提出了一种应用于整合蛋白质组学和代谢组学的方法和策略,用于研究和筛选VD的潜在生物标志物,在缺乏足够基础研究的领域可以更加精确和可靠。
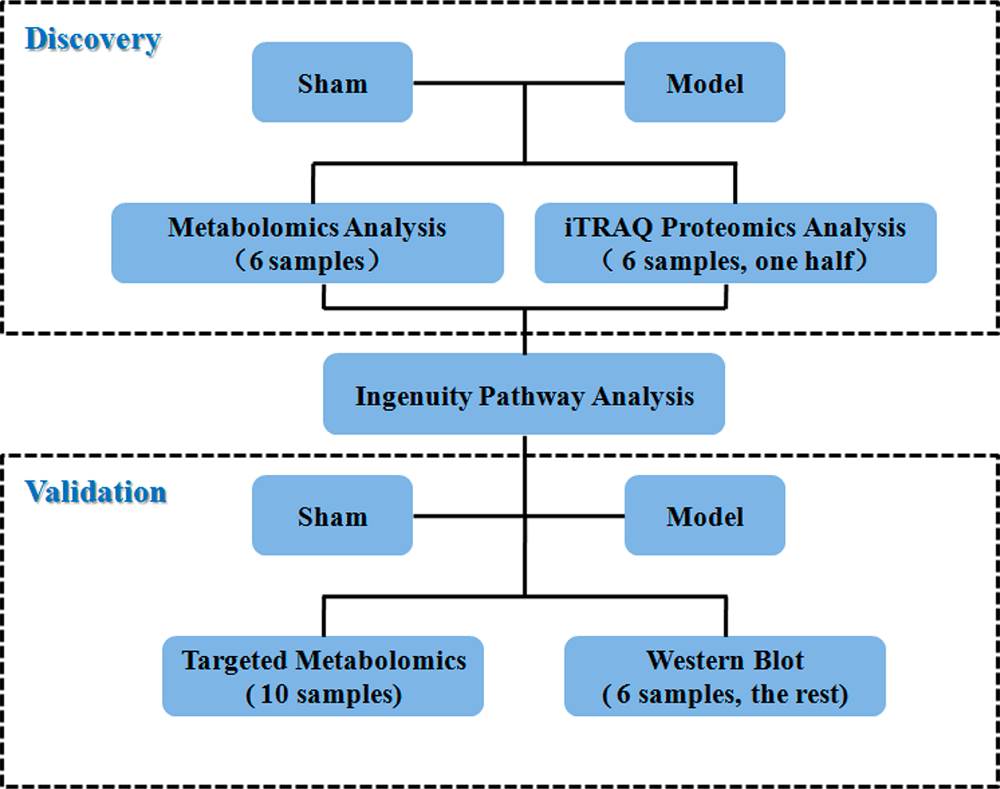
图1 实验设计
共有57只小鼠分成假手术组和模型组,其中假手术组26只,模型组31只。行为学实验结束后立即断头处死。取出海马体。每组样品中,6只小鼠的海马用于蛋白质组学分析和Western blot分析,然后6只用于代谢组学分析,10只用于代谢物靶向验证。
实验结果
代谢组学实验采用1290/6538LC-QTOF/MS进行样本检测,然后再用simca和spss等数据分析软件进行数据分析。得到结果如下:
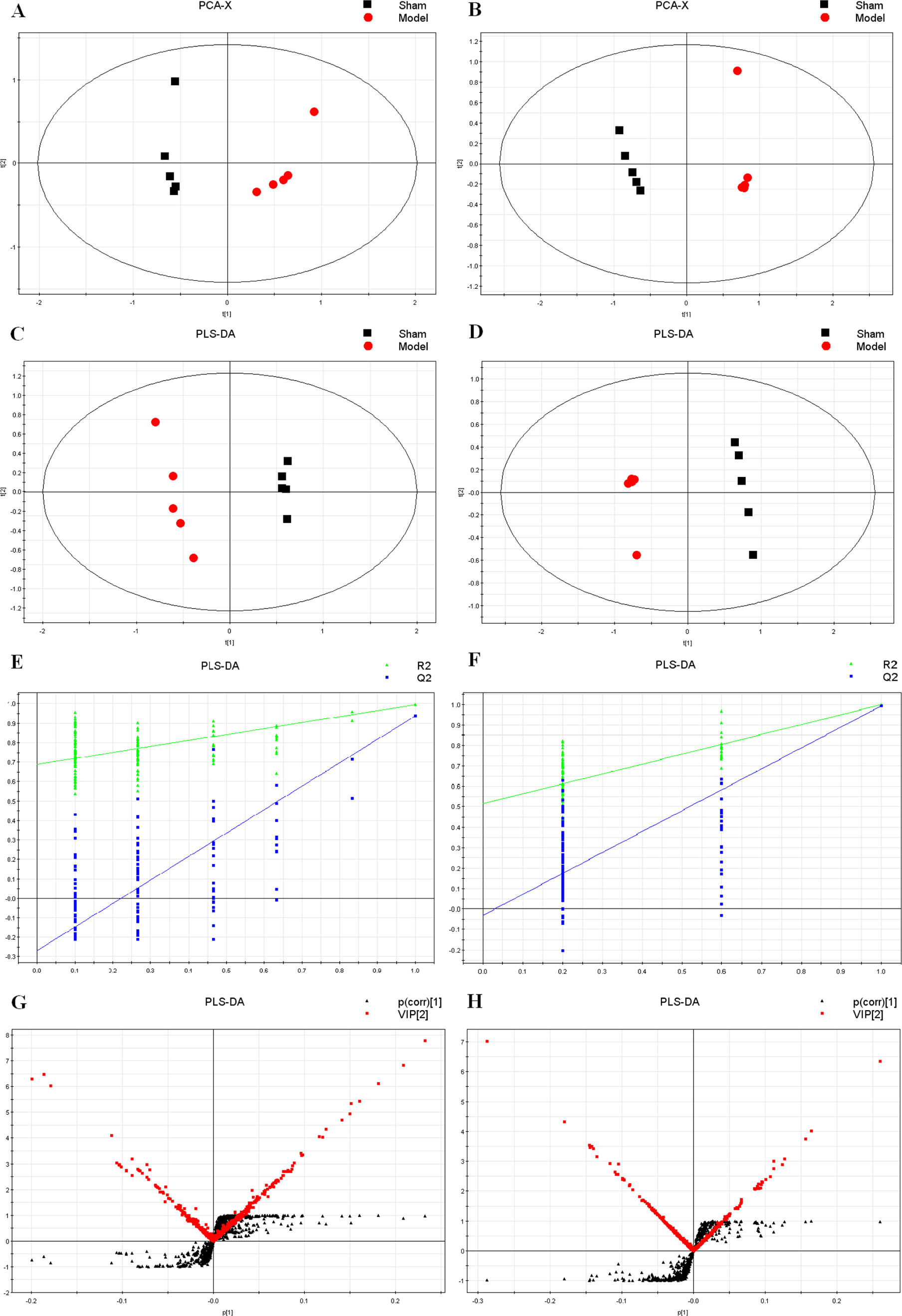
经过分析鉴定后得到如下差异代谢物:
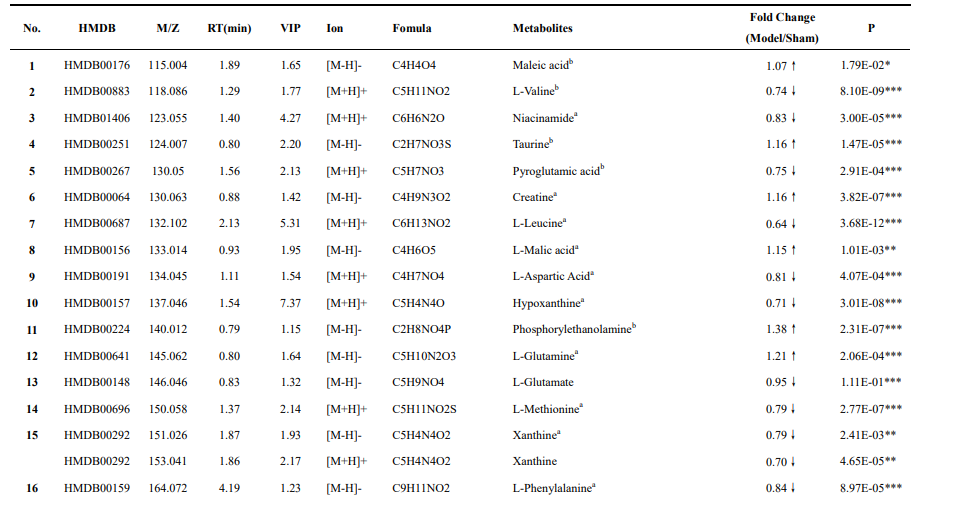


在做完非靶向代谢组学之后采用ITRAQ方法进行蛋白组学的分析,经过检测分析,得出200个差异蛋白。为了弄清VD的发病机制,作者采用IPA分析方法对非靶向代谢组学和蛋白组学得到的结果进行整合分析,结果如下:
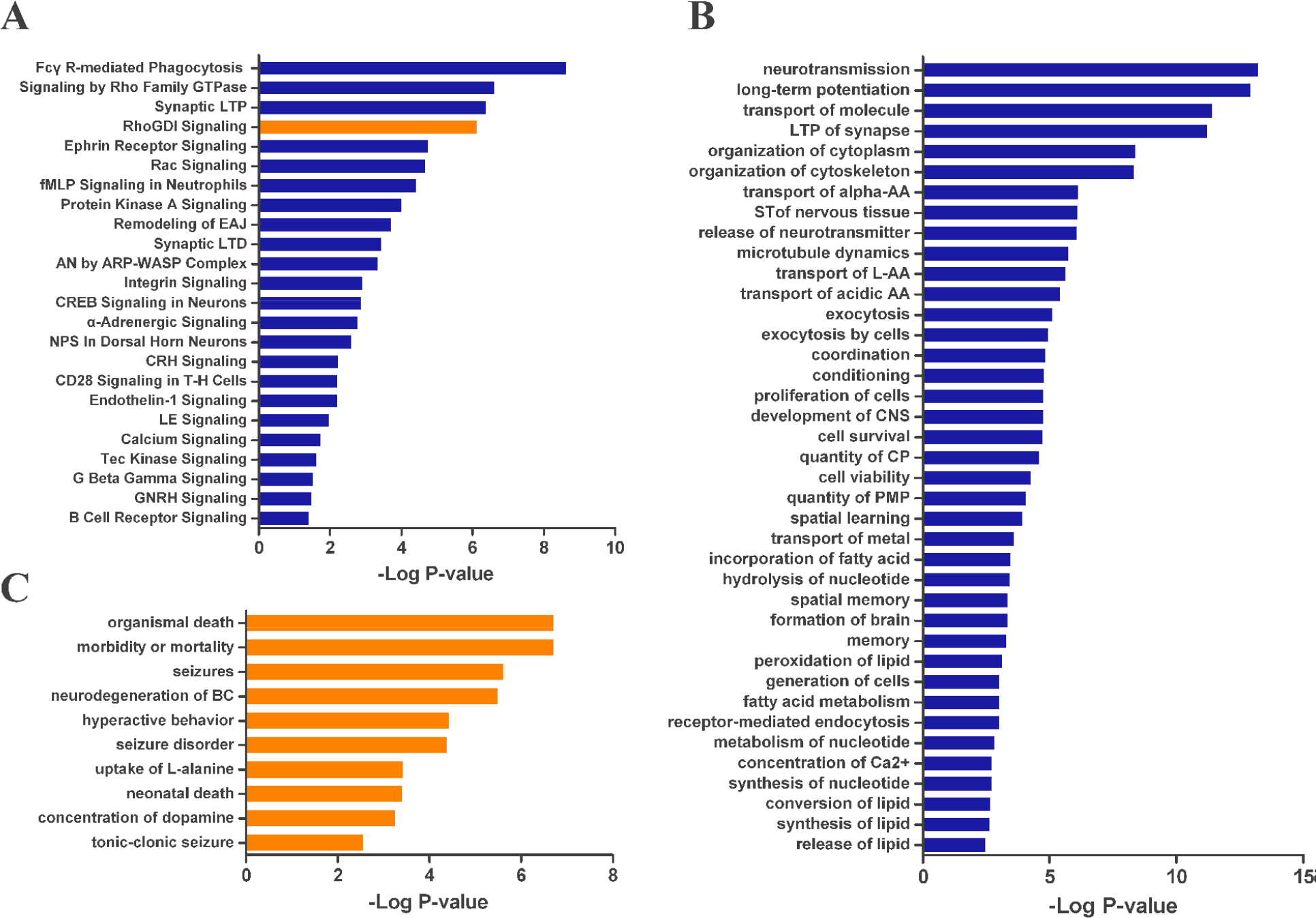
可以看出小鼠VD引起多种信号通路的改变,如突触时程增强,与免疫应答相关的通路的变化,神经调节的改变以及氨基酸转运等。经过进一步分析看出这些差异表达的蛋白质涉及细胞间的信号传导和相互作用,神经系统发育和功能,行为和神经系统疾病,氨基酸代谢,细胞功能和维持,细胞死亡和存活,脂质代谢和核酸代谢。
为了验证非靶向代谢组中鉴定的物质的准确性,作者挑选了其中的10种物质采用Agilent1290结合AB SCIEX6500进行定量 ,这10种物质如下:
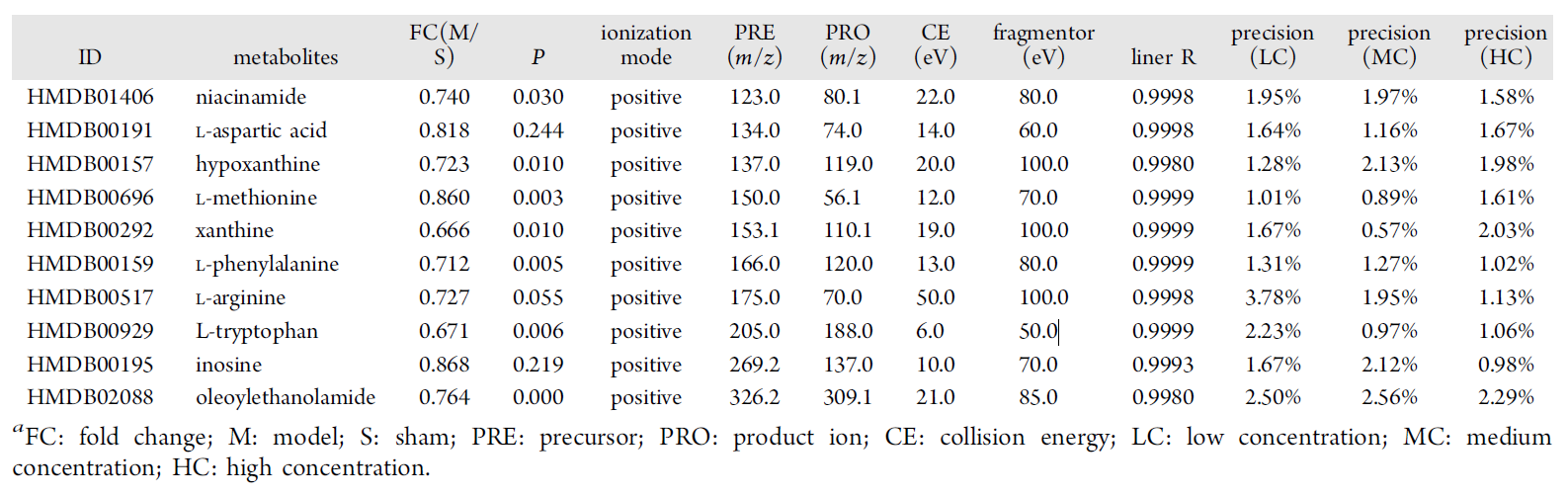

实验验证
除了代谢组学之外,蛋白组层面也选择了一些蛋白采用WB方法进行验证。经过代谢组学和蛋白组学结合IPA分析得到VD小鼠的疾病代谢机制,总结如下图:
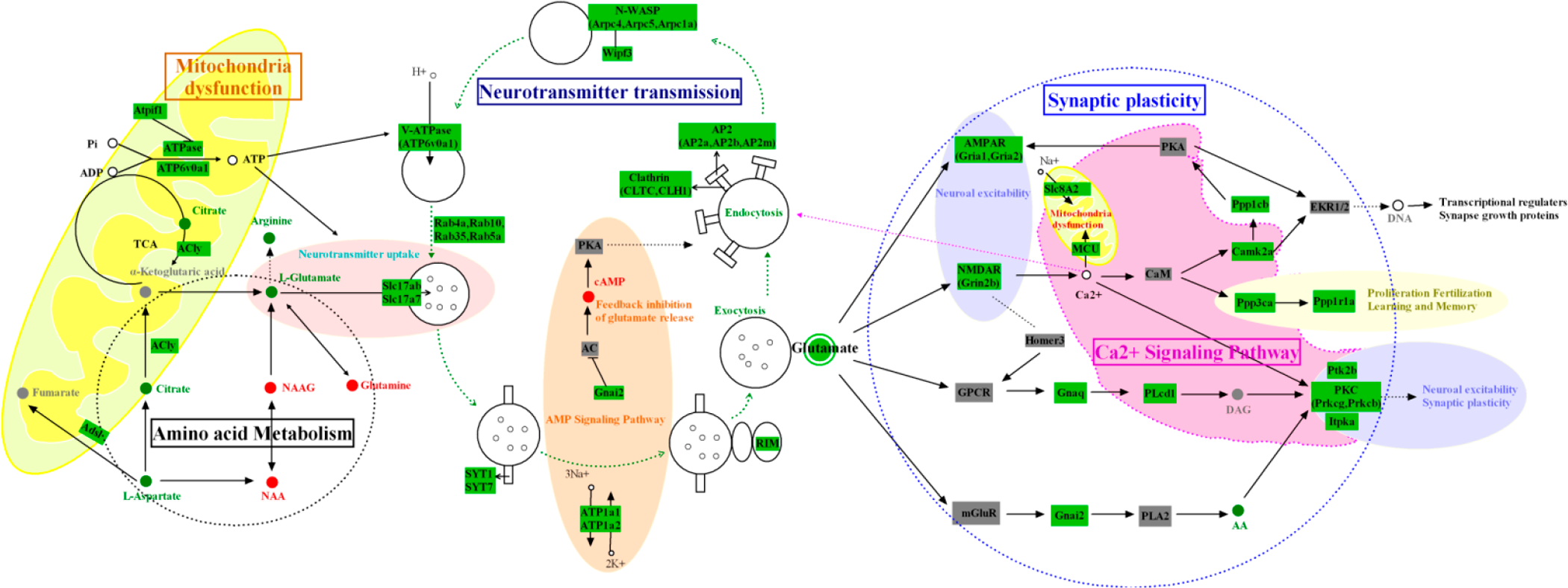
谷氨酸作为中枢兴奋性神经递质,参与中枢神经系统的信息传递。虽然谷氨酸能神经元在一些病理条件下,如帕金森病,会过度释放谷氨酸,导致细胞外谷氨酸水平增加,并产生兴奋性毒性,但研究报告称,慢性不可预见性抑郁症的海马显示出多种神经递质水平的显著降低,包括谷氨酸。分析还显示,与正常组相比,抑郁症组的谷氨酸水平显著降低。其原因是多方面的,包括神经递质内吞和外排。神经递质通过转运蛋白的囊泡被运送到胞外,研究发现两种转运蛋白SLC17A6和SLC17a7的水平在实验组中呈下降趋势,表明实验组神经递质的运输在开始时存在异常。随后,在实验组中观察到SYT1,SYT7和RIM蛋白水平的下降,其中SYT1和SYT7是突触结合蛋白,而RIM是突触膜胞吐蛋白。所有这些蛋白都参与了囊泡的初始化以及神经递质的自发和诱导释放。在释放神经递质之后,囊泡向内融合是由内吞相关蛋白(AP-2,clathrin)诱导形成的空泡。同时,在H+酸化和ATP6v0a1的作用下,囊泡继续运输神经递质,构成完整的囊泡运输周期。在这个周期的每一步中,一些关键蛋白质的水平在实验组中下调,从而影响整个细胞外排过程的效率,并最终影响神经递质的传递。另一方面,谷氨酸受体蛋白水平减少也是抑郁症状发生不可忽视的因素。更多的证据表明,NMDA受体在抑郁症的病理生理机制中在谷氨酸神经递质的传递中起关键作用。谷氨酸受体转运体水平和功能的降低导致谷氨酸摄取减少和兴奋效应降低。抑郁的部分原因是突触上谷氨酸受体数量的减少。
神经递质传递和囊泡循环的过程是一个耗能的过程,需要线粒体的能量供应。有证据表明线粒体参与了脑损伤后神经元凋亡的调节。线粒体功能异常导致线粒体氧化应激和活性氧产生,导致炎症反应和神经元凋亡,这种现象主要表现在参与线粒体功能调节的多种酶的水平上。其中,Ndufs7和Nduf11主要参与复合物I的氧化磷酸化途径,提供氢离子。ATP6v0a1和ATPase参与线粒体复合体V的ATP合成。ATPIF1是一种ATPase抑制剂,其增加将显著抑制ATPase活性。另一方面,与能量相关的代谢物包括L-谷氨酸,柠檬酸,乳酸,精氨酸在模型组也降低了。因此,当VD发生时,这些酶(Ndufs7,Nduf11,ATP6v0a1,ATPase,ATPIF1,ACly,Slc8A2)与代谢产物一起导致线粒体氧化磷酸化。从而影响ATP的合成,引起整个能量代谢障碍。
一些氨基酸和蛋白质共同参与稳态调节,在中枢神经系统(CNS)中,谷氨酸和天冬氨酸对维持神经系统稳态最重要。在正常情况下,被过量谷氨酸神经递质刺激的突触后膜向突触前膜发送反馈信号以减少谷氨酸的释放。过量的谷氨酸和N-乙酰-L-天冬氨酸(NAA)形成N-乙酰-L-天冬氨酸-L-谷氨酸(NAAG)。NAAG存在于突触前膜,是突触中一个主要的短期谷氨酸的来源。当受体蛋白下调,反馈调节减弱时,NAAG被N-乙酰化的α-连接酸性酶(NAALADase)切割成NAA和谷氨酸。NAAG作为哺乳动物海马中的内源性多肽,具有抗NMDA受体效应,并起到阻断神经递质效应的作用。VD组谷氨酸水平降低,NAAG水平升高。作者推测,NAAG的上调加剧了兴奋性神经递质的传导和作用,并且由于疾病的发生,负反馈调节作用可能不起作用。精氨酸作为哺乳动物必需的氨基酸之一,在许多生理过程中起着重要作用,如DNA和蛋白质合成,清除活性氧(ROS),抑制自噬,细胞增殖与脂质代谢。此外,精氨酸也与免疫功能的调节有关。在本研究中疾病组的氨基酸水平改变是假手术组的0.85倍,说明影响了精氨酸涉及的途径。经过分析发现与脑细胞个体死亡和神经退行性疾病发生有关的途径和功能被上调,与细胞增殖和存活、免疫调节相关的B细胞受体信号转导、核苷酸合成和脂质代谢有关的途径和功能被抑制。
实验结论
总的来说。在VD疾病状态下,海马生物分子的变化主要与神经递质传递的内部失衡有关。一方面,兴奋性神经递质及其下游蛋白水平的下调导致一系列信号通路和神经功能的紊乱,如神经可塑性降低,钙信号通路异常,神经细胞增殖和凋亡失衡,这些都与抑郁症的发生密切相关。另一方面,在VD状态下,作者发现神经递质内吞和摄入量导致了氨基酸、脂质和能量代谢异常,以及其他功能障碍和异常。




