基于GC - MS的代谢组学研究揭示:SD大鼠和Wistar大鼠之间存在系统的代谢差异及乙醇灌胃反应差异
写在前面:
大鼠被誉为精密的生物研究工具,被广泛用于内分泌、药物、行为学、老年病学、肿瘤、感染性疾病、心血管疾病及中医药等方面的研究,并具有多个品种、品系,可供不同实验选用。在分类上主要包含封闭群大鼠和近交系大鼠两大类。Sprague-Dawley(SD)大鼠和Wistar大鼠属于封闭群大鼠的类别。封闭群大鼠指不以近交形式,也不与群外动物杂交而繁衍的大鼠动物群,保持群体的一般特性,又保持动物的杂合性。
让小编带大家来分享一篇经典的使用大鼠作为研究对象的代谢组学技术方面的文献。本次分享的文献(谱领技术人员完成)主要针对封闭群大鼠中的SD大鼠和Wistar大鼠进行代谢差异研究。Wistar大鼠对各种营养物质更敏感,适用于各种营养、代谢性疾病研究。其垂体肾上腺系统发达,应激反应灵敏,因此也适用于神经-内分泌实验研究。还可用于药物、肿瘤、传染病、关节炎和肝胆外科等医学研究领域及药理、毒理和生物制品等研究。SD大鼠由Wistar大鼠培育而成,其性情较Wistar大鼠更为凶猛,且比Wistar大鼠具有更强的适应性和抗病能力,因此也更为受到动物实验的青睐,也是较为重要的实验大鼠品种。常用于营养学、内分泌学和毒理学研究。
让我们来看看本篇文献的设计思路、实验方法和结果:
SD大鼠和Wistar大鼠是具有相似遗传背景的常用实验大鼠,在实际的科研中研究人员们认为两种大鼠是可互换的。在这篇文章中,研究者利用基于气相色谱-质谱联用(GC-MS)的代谢组学技术,分析了SD大鼠和Wistar大鼠在不同扰动,如:禁食、喂饲和连续急性乙醇干预影响下的系统代谢差异。实验揭示:两种大鼠的代谢差异包含若干代谢途径的差异和肠道共生微生物区系的差异。实验结果表明,与Wistar大鼠相比,SD大鼠在禁食和摄食状态下表现出更高的个体化代谢变异,以适应环境变化,连续乙醇灌胃对SD大鼠造成的肝损伤要弱一些,SD大鼠表现出更强的适应和恢复能力,以适应连续乙醇灌胃扰动,恢复原有的代谢特征。总的来说,作者通过基于GC-MS代谢组学的尿样分析研究证明:SD大鼠和Wistar大鼠之间存在内源代谢差异。本结果对于今后使用这类动物进行各类的实验设计有参考价值。
文献解读:
1. 引言
实验动物的遗传和生理多样性为药理学、毒理学和营养学研究带来越来越多的挑战,研究者们关心如何选择适合的研究对象,如何以最低的成本获得最优的研究结果。因此有研究者记录了常用的具有相似遗传背景的不同的实验动物之间对药物、营养素和压力的易感性的差异。已知各种内在生理因素和外部影响会影响体液中的代谢物组成,内在生理因素包括物种、品系、遗传修饰、性别、年龄、生理节律和个体间变异,外部影响包括昼夜变化、压力和肠道微生物群落。SD大鼠和Wistar大鼠在代谢和遗传上是非常相似,是实验室常用的啮齿动物。在此之前,Holmes等人(2000)使用基于核磁共振(NMR)技术的代谢组学技术研究两种大鼠的代谢差异,通过主成分分析(PCA)发现SD大鼠和Wistar大鼠尿液中的代谢物存在差异,同时又使用概率神经网络理论分析,发现了这两种大鼠的代谢特征差异明显。
在平台的选择上,迄今为止,大多数此类研究是使用基于NMR的代谢组学方法进行的,该方法主要由Nicholson及其同事开创。然而,关于SD大鼠和Wistar大鼠之间代谢差异的研究仅有基于NMR的代谢组学技术来开展的。相关研究者认为基于替代技术平台探索SD大鼠和Wistar大鼠之间的差异的研究也是至关重要的,并可为NMR技术的研究结果提供补充信息。质谱分析,特别是与先进的色谱分离仪器相结合,因为具有更宽的动态范围,可重复的定量能力,以及分析显著分子复杂性的样品的能力,所以是代谢组学研究的有力工具。气相色谱与质谱联用(GC- MS)的灵敏度和分辨率比传统的核磁共振方法更好,显然是一种可靠的方法,相关文献报道,其与液相色谱-质谱联用(LC - MS)相比,对候选生物标志物的结构鉴定具有更好的可靠性。迄今,非靶向GC - MS分析已成功应用于尿液,血清样品和组织提取物的代谢组学分析。
至于研究意义,理解SD大鼠和Wistar大鼠之间的代谢差异及具体差异代谢物有助于帮助研究者增进对这两种大鼠各自的特征的认识及改进后续的数据解读。本篇文献中的研究是利用GC-MS代谢组学技术比较禁食和摄食状态中的两种大鼠的代谢差异,并比较SD大鼠和Wistar大鼠对外部干预(急性乙醇暴露)的不同反应。 该研究还观察了两种大鼠对生活环境突变的压力反应,及他们各自的内源性的独特变化。同时还测定血清和肝组织的生理参数,以支持急性乙醇干预实验中代谢组学的结果。
2. 实验材料和方法
1) 实验动物
8周龄的雄性SD和Wistar大鼠购自上海实验动物有限公司(中国),并分别饲养在不锈钢标准笼中(每笼5只SD大鼠或Wistar大鼠),在培养过程中为大鼠提供经过认证的标准大鼠饮食和可以自由饮用的水。在环境受控的大鼠培养室中维持恒定的12小时光/暗循环,室内的恒定为温度为23±1℃,湿度为60±5%。 适应1周后,将大鼠分组以进行以下实验。 另外,除非另有说明,否则所有大鼠都饲养在提供标准饮食可随意饮用的水的标准笼中。参照《中国实验动物护理和使用指南》的原则和程序进行实验动物护理和使用。 实验设计如图1(Figure 1所示。)
2) 实验的设计
实验的设计I :禁食的和喂食的状态下SD大鼠和 Wistar大鼠的比较
如图1(Figure 1实验一)所示:(A)将已经在代谢笼中适应一周的两种大鼠各20只,分别转入代谢笼。从第1天的第18小时到第2天的第9小时处于禁食状态,水可以自由饮用。在第3天到第4天的相同的时间,重复相同的禁食过程,在这个过程中两种大鼠也是只能喝水。收集两种大鼠的尿样,来进行GC-MS分析,以确定禁食期间的大鼠夜尿中的代谢物成分。(B)从第五天的第18个小时到第6天的第9个小时,在代谢笼中放入可随意取用的食物和水。收集尿液来进行GC-MS分析,以确定喂饲状态下的大鼠夜尿成分。
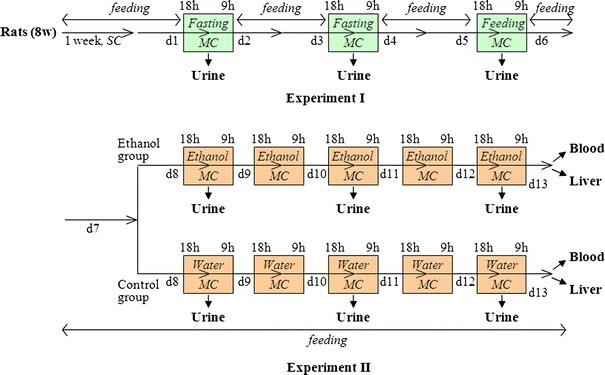
Figure 1: Flowchart of experiment designs in this study. All rats could drink water freely during the whole experiment. Key: 8 w 8-week old, SC standard cage, MC metabolism cage; 18 h(9 h), 18:00 (9:00); d1(d2,…,d13), the 1st (or 2ed,…,13th) experimental day after the initial 1 week of adaption in standard cages
实验的设计II:急性乙醇灌胃干预下SD大鼠和 Wistar大鼠的系统比较
如图1(Figure 1实验二)所示:在之后的第6和第7天两天,将实验的设计I中的雄性SD大鼠和Wistar大鼠各20只转入标准饲养笼中两天,并提供可以自由取用的食物和水。之后的第8到第13天中,SD大鼠和Wistar大鼠被各分为两组,每组有同种的10只大鼠,共4组。同种大鼠中有一组在第8天的第18小时到第9天的第9小时之间用乙醇灌胃,具体的方法是:以8ml 50%的乙醇每千克体重的量灌胃两次,两次的灌胃间隔1小时。相同的灌胃的过程连续5天重复进行。对照组大鼠(每一种对照组含10只)以相同的方式用蒸馏水灌胃。在每天灌胃处理后,立即将大鼠放入代谢笼,并收集每天的第18个小时到下一天的第9个小时的夜尿样品以进行GC-MS分析。 在第13天第9个小时后,牺牲所有的大鼠,并收集血样和肝脏组织进行肝脏的损伤的分析。
3) 血清和肝组织的样品制备和生化测定
将血样立即在9,300×g和4℃条件下离心15分钟,转移上清液(血清),用以确定生化参数。从牺牲的动物中快速切除肝组织并储存在-80℃。在分析之前,将肝组织加冰冷的盐溶液作匀浆化处理,随后将混合物在9,300×g和4℃下离心15分钟。上清液用于测定肝脏生化参数。
血清酶活性的测定,如:丙氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST)和乳酸脱氢酶(LDH)在自动分析仪(Roche / Hitachi,Modular P800)上来进行分析。此分析实验采罗氏试剂并在临床生化实验室中进行。使用试剂盒(中国建城生物工程研究所)测定肝组织酶活性,方法是:使用蛋白质试剂盒分析组织蛋白质含量。使用基于黄嘌呤氧化酶法的SOD试剂盒测量超氧化物歧化酶(SOD)活性。使用该试剂盒在37℃下反应40分钟后,在550nm的波长下测量OD值。一个SOD酶活力的单位定义为SOD抑制四氮唑蓝(NBT)光还原相对百分率为50%时的酶量作为一个酶活力单位。使用GSH-PX试剂盒测定谷胱甘肽过氧化物酶(GSH-PX)活性。一个单位的GSH-PX酶活力等于在1分钟内分解1μM的谷胱甘肽(GSH)所需的酶量,酶比活使用单位: 活力单位数/分钟/毫克蛋白(units/min/mg protein)来表示。使用丙二醛试剂盒测定肝脏的脂质过氧化(LPO)。酶活性检测方法是基于酶催化反应形成生红色发色团,在532nm处有光吸收,酶活的测定结果表示为纳摩尔丙二醛/毫克蛋白质(nmol/mg)。
4) 尿液样品的制备和GC / MS分析
收集到的大鼠的尿液样立即在5,900×g和4℃条件下离心10分钟以除去任何固体碎渣,并将上清液以等分试样的方式储存在-80℃,以进行后续的衍生化。 参照Qiu等人在2007公布的方法,使用氯甲酸乙酯对尿液样品进行衍生化并进行GC / MS分析。使用L-2氯苯丙氨酸作为此实验的一种内标(IS),用于来监测整个实验过程中GC-MS平台的性能和及实验方法的重现性。
5) GC / MS数据的提取和多变量统计分析
使用Agilent GC-MS 5975数据分析软件处理原始GC-MS数据,将原始数据转换为AIA格式(NetCDF)文件,随后可使用XCMS工具箱(版本1.14.0)处理得到的AIA格式文件,参数的设置请参照Gao 等在2009文献所报道的参数。由XCMS工具箱得到的结果,可使用Microsoft Excel软件(Microsoft,Redmond,WA)进一步处理,内标所产生的峰值、因为柱流失和衍生化过程而产生的杂质峰将被排除,剩余的离子特征峰被归一化到总积峰面积,为保留数据精确,每个峰面积乘以1000,其所占的总峰面积比例为除以1000倍总峰面积的值。 所得到的数据被排列在三位矩阵中,并包含保留时间,核质比,样品的名称,峰面积等峰参数信息。
将得到的三维矩阵导入Simca-P 11.0软件包(Umetrics,Umeå,Sweden)。使用中心平均值法 (meancentered)或者比例标准偏差法 (UV-scaled)对数据进行标量化,对于标量化后的数据进行主成分分析(PCA),在主成分得分数图上将显示所有样本中的一般聚类,趋势和异常值。 R 2 X表示当前模型的累积解释能力,其中接近1的值表示优秀的模型。同时对两种大鼠的乙醇灌胃组和对照组数据进行偏最小二乘判别分析(PLS-DA)。参照Bylesjö等人在2006年使用的方法对数据进行正交偏最小二乘判别分析,构建预测模型,以判别两种乙醇灌胃和对照大鼠的差异代谢物。R 2 Y是Y中的累积模型变化,Q 2 Y是Y中的累积预测变化。这些参数的值接近1.0表示具有预测可靠性的稳定模型。差异代谢物的判定方法是使用VIP值和P值来判定,VIP值是从最小偏二乘(OPLS-DA)模型获得的变量显著性投影值(VIP), P值是通过双尾T检验获得,在获得VIP值和P值时,使用的是基于单变量分析水平的归一化处理后的原始数据。 当某种代谢物数据的VIP值大于1.0且P值小于0.05时,即可判定此物质为差异代谢物。折叠变化计算为两个任意类别之间的平均质量响应(面积)比率的对数,其中正值表示第1类的平均质量响应大于第2类的平均质量响应。
6) 差异代谢物的鉴定
首先通过将每种化合物的保留时间、质谱图与我们实验室中的标准品的保留时间、质谱图做比较来鉴定代谢物的种类。 没有标准品的代谢物则通过对比商业数据库如NIST05来鉴定。去卷积化的质谱图谱由自动质谱解卷积和识别系统(AMDIS)生成,并被转换到NIST质谱搜索程序MS Search 2.0中,通过和MS Search 2.0程序所带的NIST标准品的质谱数据库进行比对,鉴别代谢物的种类。
3. 实验的结果和讨论:
1) 大鼠尿液中代谢物质的GC - MS分析结果
通过对对色谱图进行简单的直观检查发现,SD大鼠和Wistar大鼠的尿液样品中共有的化合物是三羧酸(TCA)循环中间体(琥珀酸、乌头酸和柠檬酸),脂肪酸(辛二酸和硬脂酸)氨基酸(甘氨酸、赖氨酸、酪氨酸和色氨酸)和芳香族化合物(对甲酚、4-乙基苯酚、马尿酸、苯乙酰甘氨酸、苯甲酸、4-羟基苯乙酸、3-羟基苯丙酸和3,4-二羟基苯乙酸)。实际上,具有相似或甚至相同基因型的群体在相同和相似的生活环境中生活时个体间代谢变异是普遍存在的。为了全面比较SD大鼠和Wistar大鼠这两种品系之间的系统代谢变异,本研究使用代谢组学常用的统计学分析手段:主成分分析法(PCA),偏最小二乘分析法对两种大鼠的尿液中代谢物的GC - MS检测数据进行了统计学分析。
2) 两种大鼠对于禁食的代谢反应
外界的压力会影响复杂的生化调节系统,并可能导致明显的代谢中断和神经心理疾病症状,如:高血压、胃溃疡、抑郁、焦虑、冷漠和胃肠功能紊乱等疾病。 在这项研究中,研究者首先对实验数据进行了主成分分析(PCA)。通过对大鼠尿液样品的数据进行主成分分析,研究者发现一些明显异常的溢出值数据。SD大鼠和Wistar大鼠在禁食实验第1天(d1)溢出值数据比禁食实验第3天(d3)多。在实验第5天(d5)即摄食状态的溢出值数据比禁食实验第3天(d3)多。研究者通过比较重复制备样品的GC / MS总离子流色谱图,进一步验证了这些异常的溢出值,并在最终分析中去除了这些溢出值。
在去除尿样GC-MS数据的所有异常值后,使用统计学方法---主成分分析法(PCA)分析数据,得到了如下的PCA得分图,见图2( Figure 2),PCA得分图显示:Wistar大鼠禁食第1天(d1)和第3天(d3)的尿液代谢物数据有显著的差异,见图2d( Figure 2d), SD大鼠禁食的第1天(d1)和第3天(d3)的尿液代谢物数据也表现出明显的分离趋势,数据的差异很明显,见图2a( Figure 2a)。这和Holmes等人在2000年的发现有所不同,Holmes等人在8天的实验期间收集SD大鼠和 Wistar大鼠的尿液样品,发现其代谢物数据不存在与采样时间相关的差异。尽管本实验仅仅在d1和d3收集了禁食的大鼠的尿液,但我们进一步检查了时间相关的差异是否也存在于随后的急性乙醇干预实验中(实验II,d8,d10和d12)的对照组中。 PCA得分图显示,乙醇灌胃实验对照组的SD大鼠和Wistar大鼠,的不同时间点之间未发现代谢物的类型和浓度的显著的差异,见图2c,f( Figure 2c,f)。这样的结果意味着两种大鼠对灌胃处理没有明显的反应。
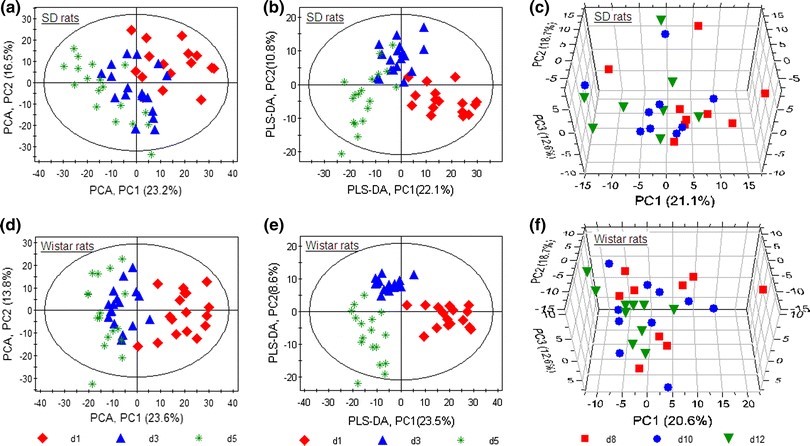
Figure 2: PCA and PLS-DA scores plots of GC/MS urinary data comparing SD rats a, b and Wistar rats d, e in fasting (d1 and d3) and feeding state (d5), and comparing three consecutive time points of control groups of SD rats c and Wistar rats f in ethanol intervention. Key: diamond, triangle, and star represent the first (d1), third (d3), and fifth (d5) day of SD or Wistar rats, respectively; box, dot, and invert triangle represent the control samples of first (d8), third (d10), and fifth (d12) ethanol intervention, respectively
使用偏最小二乘法分析法(PLS-DA)分析数据,以洞察在实验d1 (禁食)、d3 (禁食)和d5 (正常的喂饲)时尿液代谢物数据间差异。如图(图2b,e)所示:由饮食的差异造成的d3 (禁食)、d5 (正常的喂饲)的代谢物数据差异(SD大鼠PC2 (10.8%),Wistar大鼠 PC2(8.6%)),明显的小于d (禁食)、d3 (禁食)的代谢物数据间差异(SD大鼠PC1(22.1%),Wistar大鼠PC1 (23.5%))。大鼠在禁食的d1因为生活环境的变化,即从标准饲养笼转入代谢笼,导致了d1和第d3代谢数据的明显的差异。在这一项研究中,所有的实验大鼠在正式的实验之前,都被放置在标准饲养笼喂饲一周,从标准饲养笼到代谢笼的生活环境变化导致了代谢物的剧烈变化。
通过分析d1和d3之间的差异代谢物发现,生活环境的突变和和禁食共同的造成了某些芳族代谢物(包括马尿酸、3-羟基苯基丙酸、吲哚-3-乙酸、3-羟基苯甲酸、4-乙基苯酚、1,2-二羟基苯,对羟基桂皮酸)、β丙氨酸和甲基丙二酸浓度的显著降低,同时也引起了如下代谢物的浓度明显的提高:二羧酸(包括丙二酸、乙醇酸、己二酸、辛二酸的、和壬二酸)、长链脂肪酸(包括棕榈酸和硬脂酸)、另一些芳香族代谢物(包括4-羟基苯甲酸、4-羟基苯乙酸和苯乙酰甘氨酸)和氨基酸(包括脯氨酸和丙氨酸)。据报道,芳香代谢物的变化与肠道菌群的活性密切相关。大鼠的尿液中短链二羧酸和长链脂肪酸的浓度上调提示:在持续禁食的外界压力下机体通过启动生物催化的脂肪酸降解途径利用脂肪酸产生能量。以上的结果表明,生活环境的突然变化不仅强烈影响实验动物的新陈代谢,而且还引起共生肠道微生物群落的相应调整。因此,SD大鼠和Wistar大鼠的都表现出明显的空腹依赖型代谢反应。
3) SD和Wistar大鼠在禁食和摄食状态下的代谢组学差异
为了在直观的描绘两种大鼠品系在禁食和摄食状态下的代谢组学差异,去除有溢出值数据的样品,对其余样品的数据进行主成分分析(PCA)。PCA评分图(图3/Figure 3):显示SD大鼠和Wistar大鼠在禁食时在d1(图3a)和d3(图3b)代谢物的数据分离良好,有明显的差异。在喂养状态下,即在d5时SD大鼠和Wistar大鼠之间代谢物的数据分离良好(d5,图3c),有明显的差异。在利用这个模型进行数据分析时,R2X值大于0.6,可推断所有PCA模型的质量都很好。并且将模型用于预测喂饲大鼠的部分数据,可看到T-预测PCA得分图(图3d)数据的符合度良好,说明了当前模型具有良好预测能力,可解释差异群体之间的主要差异。 因此,可认为SD大鼠和Wistar大鼠之间表现出显著的生理差异。
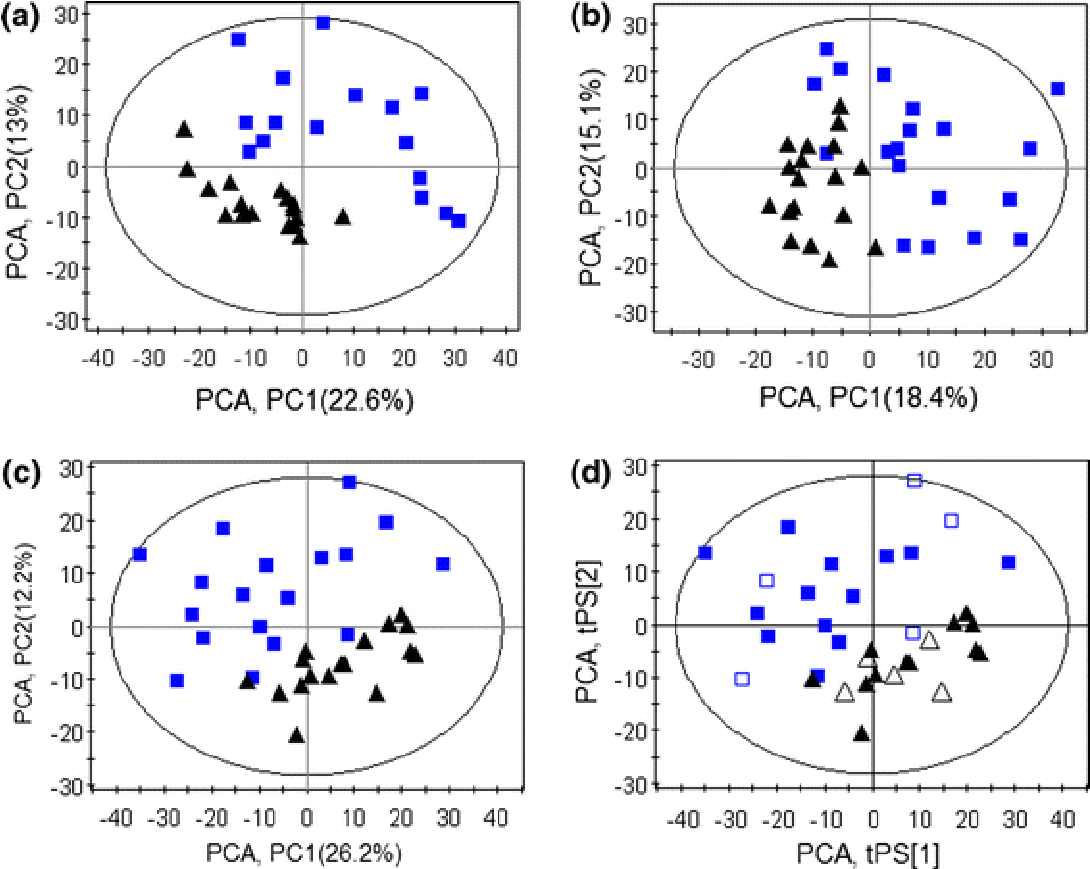
Figure 3: Scores plots of PCA on nocturnal urinary GC/MS data between SD and Wistar rats in fasting and feeding states. a Fasting SD rats (n = 16) versus fasting Wistar rats (n = 17) on d1; b fasting SD rats (n = 19) versus fasting Wistar rats (n = 18) on d3; c feeding SD rats (n = 18) versus Wistar rats (n = 17) on d5; and d T-predicted PCA scores plot between feeding SD rats and feeding Wistar rats. Key: box SD rats, triangle Wistar rats, square predicted SD rats, open triangle predicted Wistar rats.
4) 禁食或喂养时区分SD和Wistar大鼠的代谢产物的差异
为确定导致两种大鼠尿液代谢组差异的关键代谢物,选择在正交偏最小二乘判别分析(OPLS-DA)中VIP值大于1及在t检验(student’s t test)分析时P值小于0.05的代谢物作为差异化合物,如表1(Table 1)所示。在禁食状态下,Wistar大鼠排出更多的琥珀酸和氨基酸,如赖氨酸、焦谷氨酸和N-乙酰天冬氨酸,而SD大鼠排出更多的芳香族代谢物。当两种大鼠喂食相同的食物时,与SD大鼠相比,Wistar大鼠明显排出更多的琥珀酸和柠檬酸,并且其排出的芳香族代谢物更少。
Table 1: The differential metabolites between nocturnal urines of SD and Wistar rats in fasting (d3) and feeding states (d4)

aThese compounds were validated by reference standard substances.
在这项研究中,通过对实验数据进行主成分分析(PCA)揭示:两个大鼠品系在禁食和摄食状态下代谢数据明显分离。如表1(Table 1)所示,标志两种大鼠的代谢区别的代谢物是脂肪酸、氨基酸和芳香族化合物。曾经有报道指出,线粒体中脂肪或支链氨基酸的代谢紊乱通常导致大量甲基丙二酸或乙基丙二酸在组织和体液中的积累。该实验结果清楚地表明,Wistar大鼠产生比SD大鼠更高水平的两种代谢物即甲基丙二酸、琥珀酸。Mirandola等人在2008的研究表明,甲基丙二酸可抑制线粒体中琥珀酸的氧化,因此与空腹SD大鼠相比,较高浓度的琥珀酸与甲基丙二酸由空腹Wistar大鼠尿液中一起排出。此外,有趣的发现是SD大鼠尿液样品中的乙基丙二酸和甲基琥珀酸在禁食条件下均显着高于Wistar大鼠,这表明SD大鼠可能比Wistar大鼠产生更高水平的与乙基丙二酸脑病有关的代谢物。由此我们推断,在禁食状态下SD大鼠和Wistar大鼠的脂肪和支链氨基酸代谢都发生紊乱现象,且SD大鼠和Wistar大鼠两者之间存在显著的代谢紊乱差异。
如图3( Figure 3)的主成分分析(PCA)得分图显示,SD大鼠数据的轮廓更分散,因而SD大鼠表现出更高的个体代谢变异常,而Wistar大鼠数据的轮廓更加的紧密些,因而其个体代谢变异相对较小。研究者通过分析差异代谢物发现,禁食的SD大鼠的尿液中芳香族代谢物比禁食的Wistar大鼠更多,与Wistar大鼠相比,喂食进一步促进SD大鼠排泄更多的芳香族代谢物,见表1(Table 1)。已知酚酸通常与肠道菌群转化芳香族氨基酸和膳食中的酚类物质的代谢相关。我们认为同种大鼠品系内的个体间变异可能与它们的共生肠道菌群有关,这被认为是一个密切影响代谢特征的外部因素。因此,与Wistar大鼠相比,肠道微生物区系可能在SD大鼠中发挥更大的作用。已知一些口服药物和食物成分通常在被吸收之前经历肠道微生物的降解,转化或解毒。因此,在动物水平进行研究时,应考虑不同实验动物品系之间的这种差异。
5) 急性乙醇干预引起的代谢组学反应多样化 急性乙醇干预引起的代谢组学变异
在随后的急性乙醇干预实验中选择喂养的大鼠,是由于以下两个原因:(1)SD和Wistar大鼠的尿液代谢物数据在喂养时下较禁食下具有更相似的分离状态,见图3( Figure 3);(2)根据初步实验,与禁食相反,使用已喂食过的大鼠做乙醇灌胃实验可有效减少乙醇给药期间实验大鼠的死亡。尽管在第1次的乙醇干预(d8)(第8天)后,SD大鼠和Wistar大鼠的对照组数据主成分分析(PCA)得分图中PC1和PC2参数没有观察到数据分离(图中未显示),主成分分析(PCA)得分图中PC2和PC4项出现明显分离,见图4a( Figure 4a)。同样,SD和Wistar大鼠的对照组之间的清晰的数据分离仅存在于第3天乙醇干预后的PCA得分图的PC1和PC4项,见图4b(Figure 4b),或第5天乙醇干预后的PC2和PC3项,见图4c( Figure 4c)。尽管在PCA评分图中数据的分离能力降低,但目前的工作表明两种对照大鼠之间确实存在代谢差异,这与正常生理条件下的相似,参见图2c(Figure 2c)。
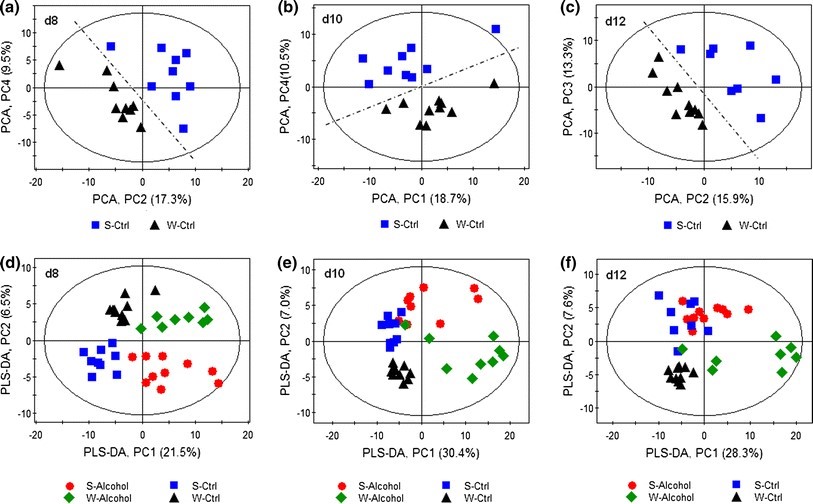
Figure 4: Scores plots of SD and Wistar rats by the consecutive ethanol exposure (d8, d10, d12). a–c the comparison of the control groups between SD and Wistar rats in three repeated ethanol intervention (PCA); d–f the comparison between the control group and ethanol group of SD rats and Wistar rats (PLS-DA). Key: dot ethanol SD rat, box control SD rat, diamond ethanol Wistar rat, and triangle control Wistar rat.
为了减少噪音数据干扰,提高信噪比,使用偏最小二乘统计分析法(PLS-DA)分析大鼠尿液的GC-MS检测数据,以评估乙醇干预对大鼠代谢特征的影响。图4d(Figure 4 d)显示,对于SD大鼠或Wistar大鼠,第1次急性乙醇干预(d8)引起尿代谢物谱显著的改变。进一步发现,在第3次乙醇干预(d10)后,见图4e(Figure 4 e),SD大鼠的乙醇组和对照组倾向于在PLS-DA的评分图上重叠,并且在第5次乙醇干预后这种重叠的趋势进一步加强(d12),见图4(Figure 4 f)。该结果暗示SD大鼠可能具有强烈的自我调节能力适应乙醇灌胃。图4d(Figure 4 d)还表明,对Wistar大鼠的第1次急性乙醇干预导致与PLS-DA评分图上的对照组明显分离,并且在第3次(图4e)和第5次(图4f)乙醇干预之后保持或甚至加强这种分离。因此,SD大鼠和Wistar大鼠对连续乙醇灌胃药显示出不同的代谢反应,其中SD大鼠比Wistar大鼠表现出更好的自我调节和适应的能力。
6) 连续急性乙醇干预引起血液和肝脏生化指标的变化
据报导,氧化应激和活性氧介导的毒性被认为是导致乙醇诱导的肝损伤和线粒体功能障碍的关键潜在机制。肝损伤之后,三种主要的血浆转氨酶:丙氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST)和丙酸脱氢酶(LDH)的活性将显着增加,并且通常是肝病诊断中最敏感的指标。 此研究实验的结果表明,连续地乙醇灌胃5天后,Wistar大鼠AST和LDH活性明显地升高(P<0.01)。同时,SD大鼠的AST和ALT水平显着增强(P<0.0),见表2 (Table 2)。 生化指标的这些变化表明,在乙醇干预过程中,Wistar大鼠可能比SD大鼠经历更多的肝损伤。
Table 2: Biochemical parameters of serum (ALT, AST, and LDH) and liver (LPO, GSH-PX, and SOD) of ethanol rats and control rats after five consecutive ethanol interventions
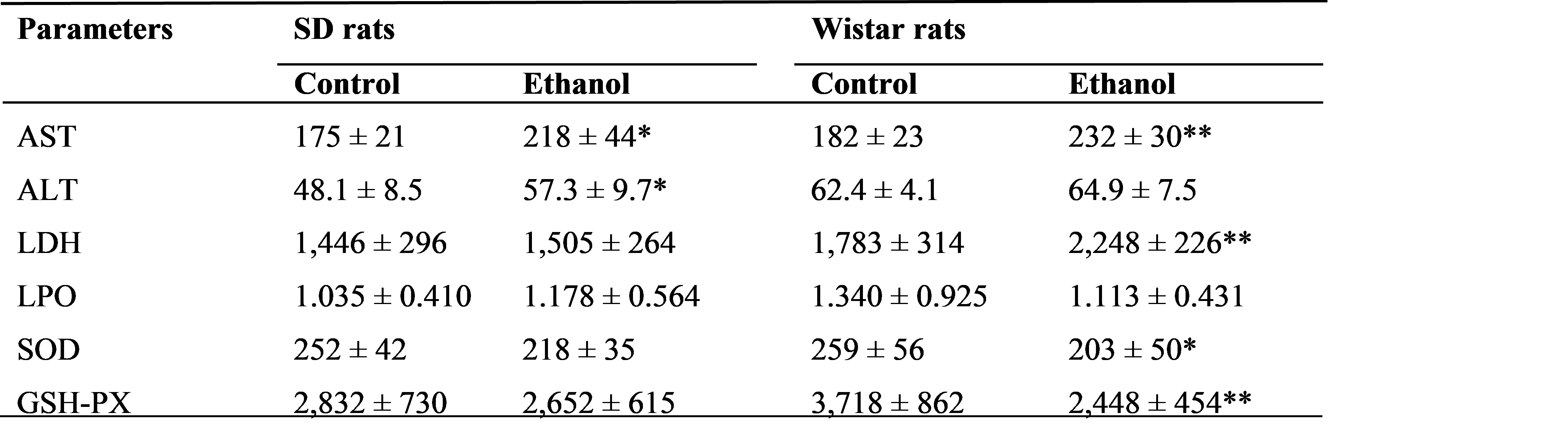
* Significant difference statistically between control group and ethanol group (P < 0.05) ** Highly significant difference statistically between control group and ethanol group (P < 0.01)
乙醇干预组的Wistar大鼠肝脏中超氧化物歧化酶(SOD)(P<0.05)和谷胱甘肽过氧化物酶(GSH-PX)(P<0.01)活性显着降低,见表2(Table 2)。然而,此研究没有观察到SD大鼠肝脏中这两种酶活力的显着降低。SOD是一种基本保护酶,负责将活性氧自由基歧化为过氧化氢和氧气。SOD活性降低导致这些活性自由基的积累,最终导致氧化代谢功能障碍,细胞损伤和生化代谢紊乱。GSH是一种主要的非蛋白巯基,在协调抗氧化防御过程中发挥着核心作用。GSH将过氧化氢代谢为水,从而保护哺乳动物细胞免受氧化损伤。本实验表明乙醇灌胃可能降低Wistar大鼠去除活性氧自由基的能力。过氧化脂质(LPO)水平通常在酒精性肝病患者的肝脏中显著增加,并间接表明自由基攻击引起的细胞损伤程度。在该研究中,实验数据的统计分析显示两种大鼠的LPO水平没有显着变化,但Wistar大鼠的肝脏中LPO平均值确实增加。Wistar大鼠中LPO水平的高个体间差异降低了统计学意义。血清和组织上述生化参数的变化表明,Wistar可能对乙醇暴露过敏,并且比SD大鼠更容易受到肝损伤。
7) 连续急性乙醇干预引起的代谢物和生化途径的变化
连续的乙醇干预后,SD和Wistar大鼠的差异代谢物数量与时间关系的变化图显示,第一次急性乙醇干预引起SD和Wistar大鼠差异表达的尿代谢物数量大致相同,见图5a(Figure 5a)。连续乙醇干预显著地增加了乙醇灌胃的Wistar大鼠和相对于对照组的差异代谢物的数量。但是连续的乙醇灌胃操作,使得在接下来的时间中,SD大鼠的乙醇灌胃的差异代谢物数量减少。这表明两种大鼠对外源性干预的适应和调整能力不同。此外,这一发现表明,在进行严格的动物实验时,最初的几次结果也可能不在考虑之列。为了获得可靠和高权重的鉴别代谢物,使用Pareto-scaled OPLS–DA模型验证、比例标准偏差法 (UV-scaled)OPLS-DA模型验证第五次乙醇干预的数据,结果进一步得到了验证,见图5b(Figure 5b)。
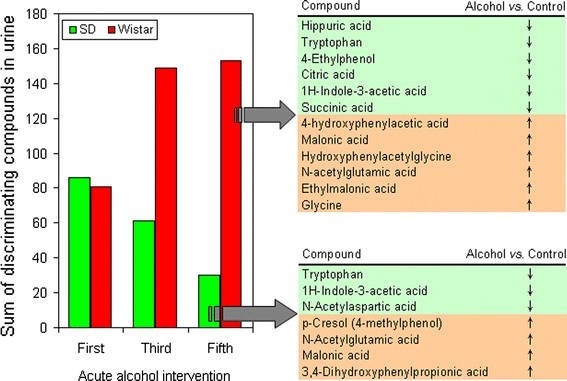
Figure 5: Discriminating compounds between ethanol and control group rats. a Time-related changes of total discriminating compounds by Student’s t test and UV-scaled OPLS-DA model (SD rats: 1 principal component, R2X = 0.159, R2Y = 0.683, Q2 = 0.279; Wistar rats: 1 principal component, 1 orthogonal component, R2X = 0.512,
R2Y = 0.909, Q2 = 0.676), and b the main discriminating compounds obtained by the further Pareto-scaled OPLSDA models (SD rats: 1 principal component, 1 orthogonal component, R2X = 0.322, R2Y = 0.814, Q2 = 0.455; Wistar rats: 1 principal component, R2X = 0.602, R2Y = 0.685, Q2 = 0.649).
本研究发现,乙醇干预改变了TCA循环,并改变短链二羧酸、氨基酸和芳香族化合物的代谢。乙醇干预诱导的氧化应激反应和线粒体功能障碍可能会导致短链脂肪酸或支链氨基酸的氧化紊乱,从而这种紊乱阻止身体将短链脂肪酸转化为能量。 在乙醇干预实验中,Wistar大鼠的尿液中丙二酸和乙基丙二酸显著升高表明它们比SD大鼠的肝损伤更多。马尿酸作为安息香酸和甘氨酸的缀合产物存在于肝脏中,其浓度与多酚摄取相关,而多酚摄取主要与肠道微生物群和肝功能有关。在Wistar大鼠的乙醇干预实验组中,尿液样品中的甘氨酸和苯甲酸的尿中含量增加(P = 0.16,没有单变量统计学意义),及马尿酸的减少表明了因肝脏受损导致的代谢功能障碍。
两种大鼠尿样中的一些有差异的芳香族代谢物是众所周知的肠道微生物的共生代谢物。图5b表明乙醇灌胃实验引起两种大鼠的尿液中对甲酚、4-乙基苯酚、4-羟基苯乙酸、3,4-二羟基苯丙酸和4-羟基苯乙酰甘氨酸明显的浓度差异。这表明两种大鼠的肠道微生物菌群的结构发生了变化。另外,乙醇干预下两种大鼠这些化合物的不同改变,如SD大鼠乙醇干预组中对甲酚的升高和Wistar大鼠乙醇干预组中4-乙基苯酚的降低, 表明两种菌株之间共生肠道微生物群落的差异。
同时,乙醇干预实验组SD大鼠和Wistar大鼠之间也存在一些一致的结果。曾有研究报道,慢性的乙醇摄入扰乱了雄性Wistar大鼠色氨酸的代谢。我们的研究结果也证明了乙醇干预实验组SD大鼠和Wistar大鼠的尿液中色氨酸和吲哚-3-乙酸的浓度比对照组都同时都减少。
基于GC -MS技术的代谢组学研究揭示了两种常用实验室大鼠品系-SD大鼠和Wistar大鼠在禁食、喂养和乙醇灌胃等实验条件下的微妙的代谢型差异。SD大鼠和Wistar大鼠均表现出对突发的环境扰动的强烈反应,环境的扰动导致两种大鼠的代谢组学变化,并伴随了共生肠道微生物群落的变化。禁食导致两种大鼠间脂肪酸和支链氨基酸的差异表达, Wistar大鼠中甲基丙二酸表达高于SD大鼠,乙基丙二酸水平低于SD大鼠。连续地乙醇干预实验揭示了SD和Wistar大鼠不同的时间依赖性代谢反应。 与Wistar大鼠相比,SD大鼠表现出更好的自我恢复能力。对大鼠尿液样品的代谢组学分析结果、以及对血液和肝脏组织样品的生化标志物分析的的结果显示,连续乙醇干预导致SD大鼠的肝损伤较Wistar大鼠弱。总之,基于GC – MS技术的代谢组学实验研究提供了SD和Wistar大鼠在禁食,如禁食,摄食状态和乙醇暴露的实验条件下的内在代谢差异的新见解,这一个发现值得今后的研究者在实验设计以及药理学和营养学研究的数据解释中全面地参考。可以利用相同的组学策略来建立不同动物种群的代谢型与人群中的代谢型之间的相关性,这将最终促进动物研究的数据向人临床终点的转化。
文献内容
Title: GC/MS-Based Urinary Metabolomics Reveals Systematic Differences in Metabolism and Ethanol Response between Sprague–Dawley and Wistar Rats
Author: Xianfu Gao,Aihua Zhao,Mingmei Zhou,Jingchao Lin,Yunping Qiu,Mingming Su,Wei Jia
Journal: Metabolomics, 7(3), 363-374
Keywords: Sprague–Dawley;Wistar Rats;GC/MS-Based Urinary Metabolomics;Ethanol;Metabolism
Abstract:
Metabolic differences of experimental animals contribute to pharmacological variations. Sprague–Dawley (SD) and Wistar rats are commonly used experimental rats with similar genetic background, and considered interchangeable in practical researches. In this study, we present the urinary metabolomics results, based on gas chromatography coupled to mass spectrometry (GC/MS), which reveal the systematic metabolic differences between SD and Wistar rats under different perturbations such as fasting, feeding, and consecutive acute ethanol interventions. The different metabotypes between the two strains of rats involve a number of metabolic pathways and symbiotic gut microflora. SD rats exhibited higher individualized metabolic variations in the fasting and feeding states, and a stronger ability to recover from an altered metabolic profile with less hepatic injury from the consecutive ethanol exposure, as compared to Wistar rats. In summary, the GC/MS-based urinary metabolomics studies demonstrated an intrinsic metabolic difference between SD and Wistar rats, which warrants consideration in experimental design using these animal strains.
解读部分根据论文主体、网络资料和现有知识整理汇总得到,如因此引起任何问题,请及时联系我们沟通改正。
如果您觉得以上文章不错,请关注我们!
从实验设计到最终的生物学分析,谱领生物提供国际一流的专家级代谢组学服务。





