Nature丨代谢流分析揭示线粒体缺陷的肿瘤细胞通过还原羧化支持生长
胸膜积液(PEs)由多种全身性炎性、感染性和恶性疾病引起。当有胸腔积液时,应寻找积液产生的原因,确保适当的治疗。根据积液形成的机制,胸腔积液可分为漏出液和渗出液。如果病人,胸腔积液为漏出液,则可以进行全身治疗,无需将注意力转移到胸膜。如果存在渗出性积液,则应检查胸膜以找出局部问题的原因。中国超过833名未确诊的胸腔积液患者成功的接受了医学胸腔镜检查,在接受内科胸腔镜检查的患者中,有40%的患者确诊为结核性胸腔积液,远高于许多国家,并且在中国最常见未确诊的胸腔积液是恶性或结核性胸腔积液。本篇文献展示了一种区分结核性胸腔积液(TBPEs)和恶性胸腔积液(MPEs)的方法。线粒体代谢为肿瘤细胞的生长和增殖提供了合成大分子物质的前体,在正常肿瘤细胞线粒体中,葡萄糖和谷氨酰胺的氧化代谢会产生柠檬酸和乙酰辅酶A来提供肿瘤发生所必需的脂质合成。然而有些肿瘤细胞在柠檬酸循环(citric acid cycle,CAC)或电子传递链(electron transport chain,ETC)中存在基因突变,从而使线粒体正常的氧化功能丧失,此时肿瘤细胞如何产生大分子合成的前提尚不清楚。代谢流分析可以定量化表征细胞代谢的动态变化和代谢途径的流量精细分布,揭示疾病发生发展过程中的主要代谢通路变化,促进对生理或病理机制的认识(谱领生物可提供)。本研究通过代谢流分析发现线粒体缺陷的肿瘤细胞是通过谷氨酰胺还原羧化而非氧化代谢来作为形成柠檬酸的主要途径。该途径利用依赖于NADP+/NADPH的异柠檬酸脱氢酶和谷氨酰胺产生的柠檬酸,产生用于脂质合成的乙酰辅酶A(AcCoA)并产生CAC代谢物和相关生物大分子合成所需的代谢中间体。研究结果揭示了一种新的谷氨酰胺依赖的代谢途径,逆转了典型CAC的许多反应来支持肿瘤细胞生长,并解释了肿瘤细胞在线粒体代谢受损的情况下如何产生CAC代谢中间体以支持肿瘤细胞的生长。

WT 143B:wild-type 143B
CYTB 143B:cytochrome b-mutant 143B
UOK 262 cell
MEF:mouse embryonic fibroblasts
实验选取两种线粒体功能不同但增殖相似的细胞(WT 143B、CYTB 143B)作为研究对象。
1.比较CYTB 143B细胞与WT143B细胞的代谢差异
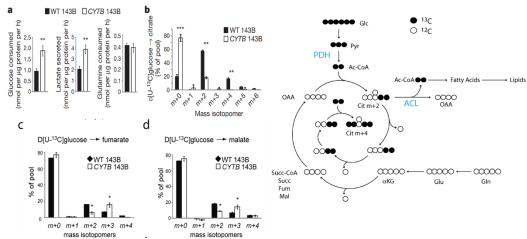
Figure 1
2.比较两种细胞中谷氨酰胺的代谢
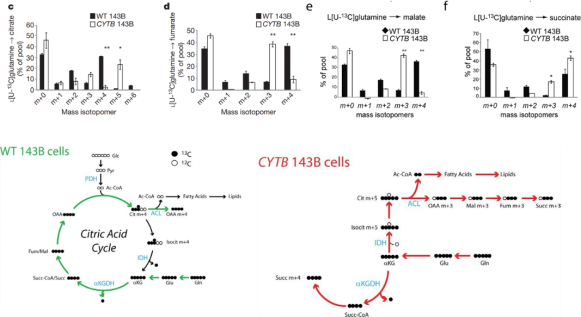
Figure 2
3.确定参与还原羧化的酶
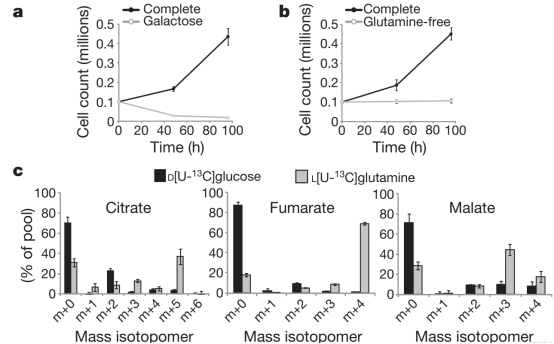
Figure 3
4.确定还原羧化是否有助于癌细胞生长所需要的脂质合成
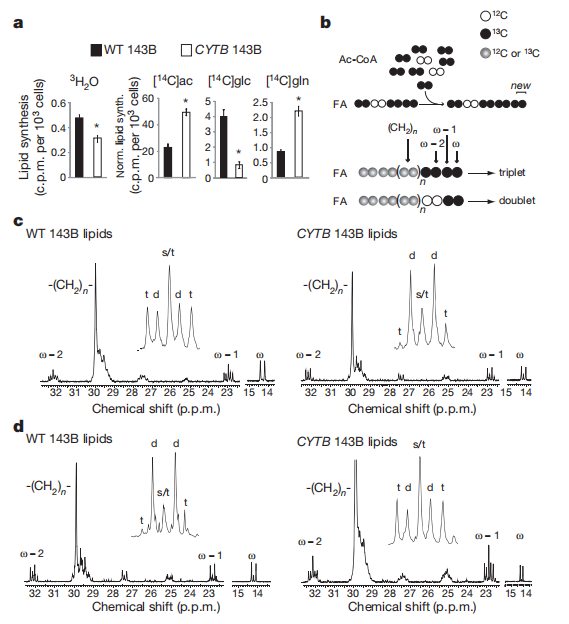
5.确定其他类似于CYTB 143B的肿瘤细胞是否也存在谷氨酰胺依赖的还原羧化

Figure 5
6.确定谷氨酸依赖的还原羧化是否是线粒体永久代谢异常细胞特有
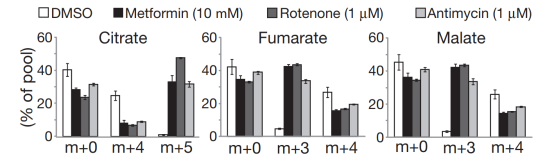
Figure 6
已有研究显示谷氨酰胺还原羧化是哺乳动物细胞中柠檬酸/异柠檬酸和脂质的次要碳来源。但本次分享的研究发现这一途径也可作为主要的代谢方式产生脂质促进癌细胞的生长,并在抑制ETC时被强烈诱导。这可能是由于ETC功能受限、NAD+/NADH比值下降、CAC氧化能力降低导致的氧化还原代谢紊乱。这种重新定向的CAC扩展了谷氨酰胺代谢在癌细胞生长中的多功能性。
Mullen A R , Wheaton W W , Jin E S , et al. Reductive carboxylation supports growth in tumour cells with defective mitochondria. Nature, 2012, 481(7381):385-8.




