对peroxisome功能的破坏会导致代谢应激,mTOR抑制和破坏肝癌细胞
过氧化物酶体(peroxisomes)是存在于真核细胞中的一种亚细胞器,呈圆形,由单层膜包裹,内含各种代谢酶类,其主要功能是参与脂质代谢,如长链脂肪酸的分解代谢和缩醛磷脂、胆固醇等的合成代谢。除此之外,过氧化物酶体还能失活过氧化氢等毒性物质,使细胞免受这些有毒物质的损害。过氧化物酶体的生物发生,即过氧化物酶体的形成过程,主要指过氧化物酶体单层膜的形成以及在膜基础上的各种蛋白质的正确组装。构成过氧化物酶体的蛋白质有两类: 膜蛋白和基质蛋白。基质蛋白主要指位于过氧化物酶体基质中的各种酶蛋白,而膜蛋白定位于过氧化物酶体的单层膜,除了某些与过氧化物酶体功能相关的蛋白外,还包括一类参与过氧化物酶体生物发生的蛋白质(peroxin,简写为PEX,由核基因pex 编码),目前已发现30 多种,如PEX2、PEX5等。
之前的研究已经证明了PEX的重要性在产后发育尤其是神经系统的发育。这些研究也显示PEXs或peroxisomes的作用对于细胞存活来说是不必要的。然而,该研究团队使用了另外一门新型关键技术——代谢组学(Metabolomics,“谱领生物”作为本次代谢组学实验的服务商),发现了PEX2和PEXs通过改变肝癌细胞新陈代谢和信号传导途径对于肝癌细胞的存活是至关重要的。该研究结果表明,PEXs可能是潜在的治疗肝癌的治疗目标。
参与过氧化物酶体生物发生的pex突变,使上述过氧化物酶体的生物发生过程不能正常进行,导致成熟的过氧化物酶体缺失而引发的疾病,称为过氧化物酶体生物发生缺陷病,即PBD。越来越多的过氧化物酶体病的病种被发现,主要有各型肾上腺脑白质营养不良(adrenoleukodystrophies),脑肝肾综合征(Zellweger病),婴儿型Refsum病,高六氢吡啶羧酸血症,肢近端型点状软骨发育不良等,尽管peroxisomes的紊乱有灾难性后果,但是通过没有peroxisomes的酵母和来自Zellweger综合症患者的细胞或peroxins基因敲除的老鼠能够正常生长,证明了peroxins对细胞来说是可有可无的。
以下为大家简单解读下本论文,本论文选择4种肝癌细胞,HepG2-C3A, SNU-475 ,SNU-449和SMMC-7721,分为2组,shNC和shPEX2。shPEX2组对进行PEX2慢病毒感染,shNC组作为阴性对照。如下图1所示;对照组的细胞能够正常生长,但是shPEX2组的细胞衰竭并抑制生长,但是非目标活动的shRNA可能导致有害的毒性,随后引入了沉默PEX2的突变体,最终实验也表明PEX2缺失强力抑制细胞的增殖。

图1
为了验证PEX2缺失细胞是否能够在体内增长。通过有萤火虫荧光素酶表达的SMMC -7721和HepG2-C3A细胞感染shPEX2和shNC慢病毒,然后分别接种到右边和左边裸色的老鼠中。通过分析荧光素酶的活性来确定异种移植的生长情况。如图2所示,异种移植的SMMC -7721和HepG2-C3A缺失PEX2的细胞生长情况和细胞培养生长一样强烈,当预计,异种移植的肿瘤体积和重量随着PEX2被除尽时,急剧减少。所以PEX2对于HCC细胞的生长至关重要。
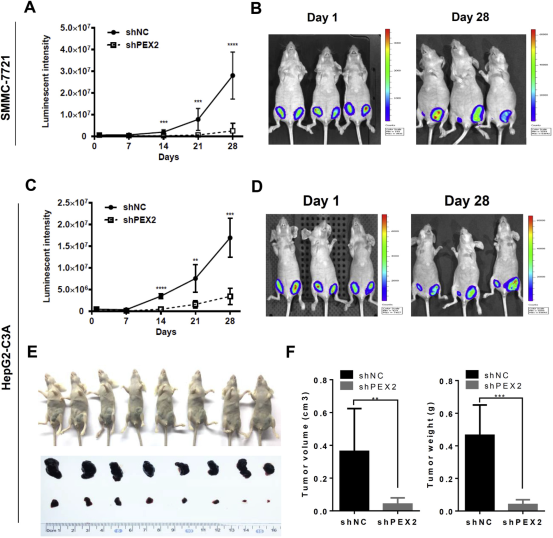
图2
通过代谢组学检测,也发现对pex2缺失的细胞的代谢状况有了深刻的改变,哺乳动物的多氧化酶体负责分解代谢各种基质,包括支链脂肪酸(BCFA),长链脂肪酸(VLCFA),磷脂,氨基酸,和碳水化合物。
PEX2缺失细胞通过脂质组学分析得到的大量质谱数据,其中几种脂质含量降低了包括磷脂(PC),PC(33:1),PC(36:2),PC(31:0),PC(37:2),PC(35:3),PC(29:0),plasmenyl-PC(34:1)和plasmenyl-PC(42:5)。在真核细胞中磷脂酰乙醇胺(PE),磷脂(PS)和PC构成胞膜磷脂的主要物质。
另外,从代谢组学获得的非靶向数据分析显示有36种不同的代谢物(shPEX2:shNC,23个下调节,13个上调),大多数代谢物来自于常见的代谢途径包括戊糖磷酸途径(PPP)和嘌呤和嘧啶新陈代谢(本次脂质组学和代谢组学实验的服务是由谱领生物提供)。如图3所示;
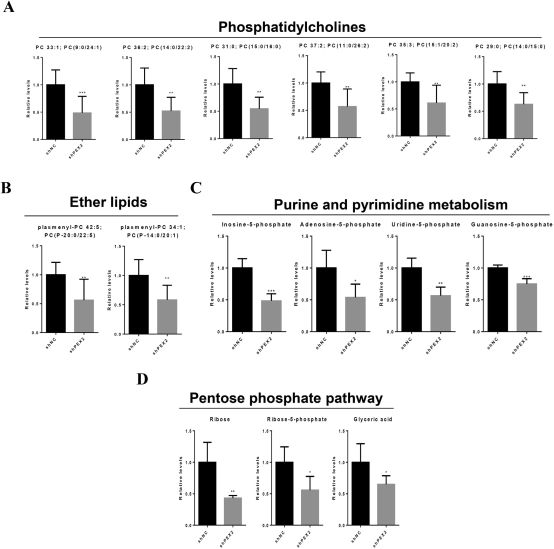
图3
过氧化物酶体有各种各样的抗氧化酶,它在平衡细胞氧化还原过程中起着至关重要的作用。考虑到过氧化氢酶的错误定位,预期在pex2缺失的细胞中进行氧化还原会发生破坏。文章中用二氯荧光素荧光探针测量细胞ROS的水平。实际上,pex2缺失的细胞内的ROS水平相比于对照细胞上升了2倍,过度表达PEX2可能会降低ROS的水平,也会导致线粒体的功能发现一系列变化;细胞内ROS的平衡也会影响内质网的分泌和膜蛋白折叠,细胞内ROS水平上升导致了蛋白质错误折叠的压力。pex2的缺失会激活内质网应激反应,如PERK, Erol-La, PDI 和 CHOP水平会上升。如图4所示;
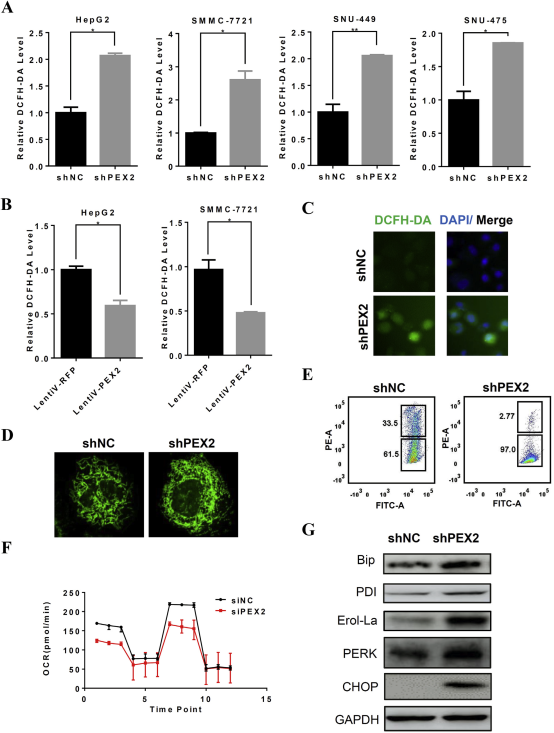
图4
为了解决PEX2敲除细胞如何抑制HCC细胞生长的问题,文章中测试了几种HCC细胞系细胞凋亡和细胞自噬周期分布是否有变化,在PEX2敲除的细胞中观察到细胞周期分布的差异没有明显的。然而,PEX2敲除细胞自噬和细胞死亡水平显著升高。通过GFP-LC3和RFP-LC3定位分析发现自噬体数量的显著增加。细胞自噬与mTOR信号相关,如图5所示,在pex2-深度的细胞中,与对照细胞相比mTORC1信号被高度抑制,除了抑制自噬,mTOR信号还维持细胞代谢,包括脂质合成和通过戊糖磷酸途径合成核糖核酸。
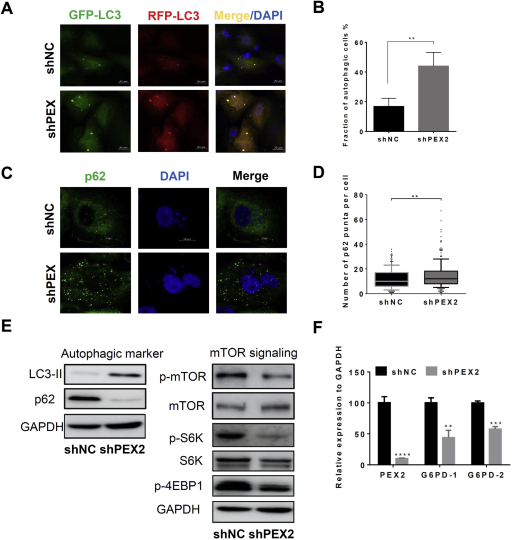
图5
HCC细胞中的过氧化物酶功能障碍导致代谢改变,如下图6所示,PEX2缺失细胞在ROS水平上的增加,表现出高度的氧化应激和线粒体形态和功能的改变。在pex2缺失的细胞中,ROS水平的增加可能是抑制mTORC1信号传递的主要原因,进而导致新陈代谢的进一步改变包括通过戊糖磷酸途径和细胞自噬减少葡萄糖流量。这些改变最终导致细胞死亡。
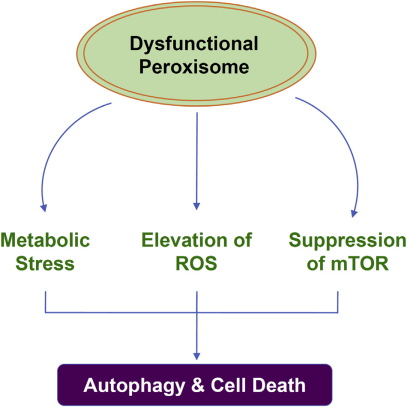
图6
最后作者提出通过在HCC细胞中,peroxin损耗实验表明了peroxins可以作为治疗肝癌的潜在的药物。这篇论文,研究团队的成果也拓展了我们对于peroxin与肝癌细胞间关联的认识,提出了未来对于肝癌治疗的一种新的模式。




