学术研究动态: 铁死亡与重大慢性疾病!!!
铁死亡与重大慢性疾病
铁死亡是近年发现的一种铁依赖的新型细胞死亡方式。其特征是脂质过氧化物和活性氧簇的过量蓄积。大量研究表明,铁死亡不仅在重大慢性疾病的发生发展过程中发挥重要作用,而且在不同的疾病背景下扮演不同角色。目前认为,铁死亡可抑制肿瘤生长并增加多种肿瘤对化疗药物和免疫治疗的敏感性。因此诱导铁死亡的发生拓展了肿瘤治疗思路。然而,在心脑血管疾病和神经退行性疾病中,铁死亡的发生通过引发正常组织器官损伤和功能丧失直接参与疾病的发生、发展及转归。因此针对心脑血管疾病和神经退行性疾病,抑制铁死亡的发生能够有效预防并延缓这些疾病的发生和发展。
慢性疾病是指非传染性、病程长且病情迁延不愈的疾病。主要包括心脑血管疾病、肿瘤、糖尿病及慢性呼吸道疾病等。铁死亡是一种铁依赖的非凋亡形式的细胞死亡方式。在形态学、遗传学、代谢学和分子生物学等方面均不同于凋亡、焦亡或坏死等细胞死亡方式。其主要特征是脂质过氧化物和活性氧过量积累。因此铁代谢和脂质过氧化在铁死亡通路中发挥重要调控作用。其可能的分子机制见图1。
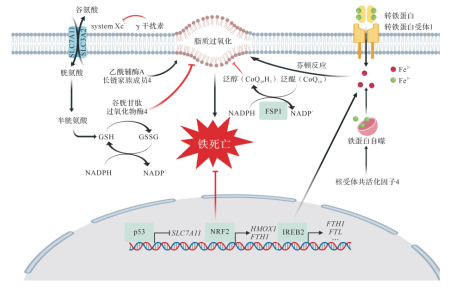
图1:铁代谢和脂代谢途径通过诱发脂质过氧化最终导致铁死亡,而谷胱甘肽过氧化物酶和铁死亡抑制因子1(FSP1)等通过抑制脂质过氧化而抑制铁死亡。
FTH1:铁蛋白重链1;FTL:铁蛋白轻链;GSH:还原型谷胱甘肽;GSSH:氧化型谷胱甘肽;HMOX1:血红素加氧酶1;NADP+:氧化型烟酰胺腺嘌呤二核苷酸磷酸;NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸;NRF2:核因子E2相关因2;SLC7A11:溶质载体家族7成员11;systemXc-:谷氨酸/胱氨酸反向转运体;IREEB2:铁反应元件结合蛋白2。
1. 铁死亡与肿瘤
肿瘤细胞可以通过规避细胞死亡而增殖;而细胞凋亡、坏死、自噬等死亡方式在肿瘤的发生发展中同样发挥了重要作用。
1.1 铁死亡与肝细胞癌
铁死亡是治疗肝细胞癌的潜在作用机制之 一。成视网膜细胞瘤(Rb)蛋白缺失的癌细胞对索拉非尼诱导的铁死亡更加敏感,可能原因是其通过影响线粒体中的活性氧浓度从而导致氧化应激反应增强。此外,Sun等研究发现核因子E2相关因子2(NRF2)在索拉非尼诱导的肝细胞癌细胞铁死亡过程中发挥保护作用,提示靶向p62-Keap1-NRF2通路可能克服肝癌细胞对索拉非尼的耐药。另外,NRF2还通过胱硫醚酶途径诱导促进铁死亡重要负向调节因子金属硫蛋白 (MT)1G的表达,导致癌细胞对索拉非尼耐药CDGSH铁硫结构域1能够保护肝细胞癌细胞中 的线粒体避免铁死亡,同时能被Erastin以铁依赖的方式上调。此外,肝细胞癌细胞携带的 p53s47突变通过抑制ACSL4导致铁死亡耐受。在肝癌中,铁死亡相关基因的表达与患者预后有关。Kinoshita等比较了130例肝细胞癌组织及癌旁正常组织中SLC7A11的mRNA表达水平发现在肝细胞癌组织中的表达量比其在正常组织中增加,且SLC7A11高表达的肝癌患者的生存期和无病生存期均明显短于SLC7A11低表达的肝癌患者。此外,在索拉非尼治疗肝细胞癌患者的过程中Rb和MT1高表达也与患者的不良预后有关。
1.2 铁死亡与胰腺癌
胰腺癌主要发生机制为突变的KRAS基因将胰腺导管腺癌(PDAC)细胞重新编码为对细胞凋亡具有高度抵抗性的状态。青蒿琥酯能通过生成活性氧诱导肿瘤细胞发生凋亡。Eling等研究发现,青蒿琥酯能够诱导KRAS突变的PDAC细胞发生铁死亡,而该过程可被Fer-1有效抑制。Yamaguchi等发现天然产物荜苃酰胺可通过促进活性氧生成诱发肿瘤细胞铁死亡,其抗肿瘤细胞效果能够被抗氧化剂、铁死亡抑制剂和铁螯合剂等抑制;荜苃酰胺、Cotylenin A (一种植物生长 调节素)和柳氮磺胺吡啶联合使用对胰腺癌有很好的协同治疗效果。研究结果提示铁死亡诱导剂有望应用于胰腺癌的治疗。
1.3 铁死亡与肾细胞癌
肾细胞癌起源于肾实质泌尿小管上皮系统,是泌尿系统中恶性度较高的肿瘤。Yang等发现GPX4是肾透明细胞癌细胞铁死亡信号通路中的关键调节因子,肾癌细胞相比其他七种组织来源的肿瘤细胞(肺癌、结肠癌、中枢神经系统、黑色素瘤、卵巢癌、乳腺癌和白血病)对抑制GPX4诱导的铁死亡更敏感。肾癌细胞通过肝细胞因子-1β-1酰基甘油-3磷酸氧酰基转移酶3(AGPAT3)轴和H1F-2α-HILPDA途径诱导,该途径能够诱导多不饱和脂肪酰基脂质富集的细胞状态。从而增加其对铁死亡的敏感性。最近美国杜克大学Yang等发现肾癌细胞对铁死亡的敏感性受细胞密度及转录调节因子1(TAZ)-TAZ调控表皮膜蛋白1(EMP1) –NOX4通路调控。提示TAZ是一个潜在的靶向铁死亡的治疗靶点。
1.4 铁死亡与乳腺癌
乳腺癌来源于乳腺上皮组织。Ma等发现溶酶体干扰剂西拉美新和酪氨酸激酶抑制剂拉帕替尼能够破坏乳腺癌细胞内铁稳态产生活性氧并诱导细胞发生铁死亡,过表达铁转运蛋白1或铁螯合剂能够减少西拉美新和拉帕替尼诱导产生的活性氧。有研究表明,黏蛋白1C亚基与SLC7A11、CD44v形成复合物后能上调还原型谷胱甘肽表达抑制三阴性乳腺癌细胞发生铁死亡Timmerman等发现一个谷氨酰胺营养缺陷型的三阴性乳腺癌细胞亚群,高度依赖SLC7A11获取胱氨酸进行谷氨酰胺代谢。SLC7A11抑制剂柳氮磺胺吡啶能够通过促进铁死亡从而抑制肿瘤生长。此外,SLC7A11和谷氨酸/胱氨酸反向转运体的活性能被Keap1/NRF2氧化还原通路调控。Lanzardo等认为SLC7A11与三阴性乳腺癌细胞的耐药和转移存在密切联系,乳腺癌细胞中TFR1表达增加与雌激素受体表达呈负相关,且乳腺癌组织TFR1高表达与患者不良预后有关。
2. 铁死亡与神经退行性疾病
铁稳态代谢对于大脑和神经发育及其认知功能至关重要,特别是在胎儿期或新生儿早期,铁缺乏会严重影响神经发育,导致记忆和学习能力减退。随着年龄的增长,铁在大脑中逐渐蓄积,大量研究表明铁蓄积与阿尔茨海默病、帕金森症、肌萎缩侧索硬化等神经退行性疾病有关。此外,近年研究发现在神经退行性疾病和认知障碍中存在脂质过氧化增加、谷胱甘肽减少和GPX4抑制等铁死亡发生的主要特征。运用铁死亡抑制剂能够有效保护神经元,提高认知能力。
2.1 铁死亡与阿尔茨海默病
阿尔茨海默病患者存在金属代谢的失稳态、炎症反应、氧化应激、线粒体功能异常和神经胶质功能受损。研究表明,大脑铁蓄积与老年斑和神经元纤维缠结形成有关,脑内铁水平升高可增加罹患阿尔茨海默病的风险且脑脊液中的铁蛋白水平可预测从轻度认知障碍到阿尔茨海默病发展的进程。此外,阿尔茨海默病伴随的慢性炎症、神经元变性及缺少下游凋亡的指标提示了阿尔茨海默病中存在铁死亡等其他细胞死亡方式。在一项研究中,大脑皮层和海马神经元GPX4特异性敲除小鼠在水迷宫实验中表现出认知下降和海马神经元退化,给予富含维生素E的饮食或Lip-1后,小鼠神经元退化得到明显缓解,提示铁死亡在神经元退化过程发挥了重要作用。另一研究发现,过表达或过磷酸化 τ 蛋白能够诱导神经元发生铁死亡,而α硫辛酸能够通过下调Tfr1、降低p38磷酸化水平和上调Sla7a11、Gpx4表达等方式挽救神经元。此外,阿尔茨海默病小鼠模型喂食氘化多不饱和脂肪酸能够缓解脑组织的脂质过氧化,减少β淀粉样蛋白沉积。
2.2 铁死亡与帕金森症
帕金森症的一个重要特征是神经元和黑质神经胶质的铁蓄积,且铁蓄积浓度与疾病严重程度呈正相关,帕金森症患者及小鼠模型中观察到铁调节蛋白1(IRP1)、二价金属转运蛋白1(DMT1)等关键铁稳态蛋白水平发生了显著变化。τ基因敲除的小鼠中出现帕金森症状并伴有黑质铁蓄积,这一现象可被铁螯合剂阻止。帕金森症在病理进程中除了黑质致密部铁升高,还出现还原型谷胱甘肽耗竭和脂质过氧化等铁死亡的特征,铁螯合剂和N-乙酰半胱氨酸可缓解并改善帕金森症患者和帕金森症小鼠模型的部分症状,提示铁死亡可能参与了帕金森症的发生和发展。DoVan等在LUHMES胞系、脑组织切片体外培养和1甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的帕金森症模型中发现多巴胺能神经元存在铁死亡,而用Fer-1、Lip-1和铁螯合剂能缓解或逆转帕金森症的症状。Gouel等发现人血小板裂解液可使LUHMES细胞抵抗Earstin诱导的神经元铁死亡。此外,星形胶质细胞有很强的储铁能力,可防止神经元中的铁过载。星形胶质细胞为神经元提供谷胱甘肽S-转移酶Mu2(GSTM2)和其他抗氧化因子,以保护神经元免受氧化损伤。综上,星形胶质细胞与神经元相互作用失调可能可导致多巴胺能神经元发生铁死亡。
2.3 铁死亡与肌萎缩侧索硬化
肌萎缩侧索硬化模型小鼠脑中存在铁蓄积,铁螯合剂的治疗效果证实了铁在肌萎缩侧索硬化发病中的作用。肌萎缩侧索硬化患者的脑脊液和血浆中脂质过氧化升高,运动皮质中还原型谷胱甘肽水平下降,表明可能存在铁死亡。小鼠神经元中敲除Gpx4可出现肌萎缩侧索硬化症状,主要表现为迅速瘫痪、严重的肌肉萎缩和死亡,这与脊髓运动神经元的铁死亡有关。而在神经元Gpx4诱导性敲除和其他Gpx4选择性皮层神经元敲除小鼠模型的皮层中未观察 到明显神经变性,提示Gpx4在脊髓运动神经元的铁死亡过程中发挥重要作用。
3.铁死亡与心脑血管疾病
心脑血管疾病中心肌细胞和神经元死亡与多种细胞死亡方式有关,铁死亡也参与其中。
3.1 铁死亡与心血管疾病
心脏在一些病理情况下能导致铁的过度蓄积、活性氧的产生及膜脂的病理转变,这都是构成铁死亡的重要因素。目前直接将铁死亡与心血管疾病相联系的研究较少。2019年的最新研究成果首次揭示了铁死亡在心肌病和缺血再灌注诱发的心脏损伤中的重要作用,这一 里程碑式的发现为心肌病等心脏疾病防治提供了新策略。
3.1.1 铁死亡参与缺血再灌注引发的组织器官损伤
心脏缺血再灌注时会产生过量活性氧、脂质过氧化及血红素中铁释放所致铁蓄积。Gao等建立了离体小鼠心脏缺血再灌注模型,发现抑制谷氨酰胺代谢可抑制铁死亡,进而减轻心脏损伤,Fang等建立了在体心肌缺血再灌注模型,发现Fer-1和铁螯合剂能够明显减轻缺血再灌注的急性和慢性心脏损伤,证实铁死 亡在心脏缺血再灌注损伤中的作用。此外,铁死亡还参与肾脏和肝脏中的缺血再灌注损伤过程。
3.1.2 铁死亡参与抗肿瘤药物诱导的心肌损伤
阿霉素作为广谱抗肿瘤药物,因其心脏毒性而限制了其在临床的使用。自噬、凋亡及坏死等多种细胞死亡方式参与阿霉素引起的心肌损伤。Fang等在凋亡和/或坏死性凋亡缺陷的小鼠中用阿霉素诱导心肌病,发现小鼠心肌细胞出现了铁死亡的特征,并提出血红素加氧酶1可能是其关键调控因子;通过亚细胞定位,发现心肌细胞铁蓄积和脂质过氧化发生于线粒体,靶向线粒体的抗氧化剂MitoTEMPO能够有效抑制铁死亡进而保护心脏。
3.1.3 铁死亡参与心脏移植后心肌损伤
Li等发现,心脏移植手术后发生的中性粒细胞募集现象是由铁死亡调控的,供体心脏在移植后由于缺血、缺氧等原因可诱导心肌细胞发生铁死亡,细胞内容物释放并通过TLR4/Trif/I型干扰素通路募集中性粒细胞,造成坏死性炎症。Fer-1能降低心脏移植后过氧氢花生四烯酰基磷脂酰乙醇胺 的水平ꎬ减少心肌细胞死亡和中性粒细胞招募。
3.2铁死亡与脑血管疾病
缺血性脑卒中和出血性脑卒中均可导致神经元发生铁死亡。
3.2.1 铁死亡与缺血性脑卒中
在铁死亡被发现前,临床及缺血性脑卒中动物模型中已证实铁蓄积能够加重再灌注时的神经元损伤。铁螯合剂可降低实验动物在缺血性脑卒中后再灌注的损伤。Speer等提出,大脑缺血后铁死 亡导致了神经元死亡,缺氧诱导因子脯氨酰羟化酶可能是铁螯合剂产生有益作用的靶点。研究发现,在大脑中动脉阻塞小鼠模型中抑制铁死亡能够保护神经元免受缺血再灌注损伤。
3.2.2铁死亡与出血性脑卒中
Chang等发现,(-)-表儿茶素能够通过减少大脑铁蓄积和铁死亡相关蛋白表达来缓解出血性脑卒中的早期脑损伤。之后又发现,Fer-1能缓解血红蛋白诱导的脑切片细胞死亡,以及缓解胶原酶诱导的出血性脑卒中小鼠模型中神经元的死亡。同时,Zille等发现Fer-1、去铁胺等铁死亡抑制剂能够抑制小鼠原代神经元死亡,急性出血性脑卒中大鼠Gpx4表达水平急剧下降,增加Gpx4水平能够避免神经元发生继发的铁死亡损伤并改善出血性脑卒中的预后。因此,铁死亡通路可能参与脑卒中神经元死亡的过程。推测靶向抑制铁死亡可能是 缓解脑卒中的有效治疗方式。
4. 总结
除了铁死亡与肿瘤、心脑血管疾病和神经退行性疾病,铁死亡在非酒精性脂肪肝和非酒精性脂肪肝炎等肝病中也有报道。活性氧诱导的铁死亡可抑制肿瘤生长,增加肿瘤细胞对化疗和放疗的敏感性。与肿瘤治疗策略相反,铁死亡可促进神经退行性疾病和心脑血管疾病的发生、 发展,因此相关转化医学研究主要聚焦于发现可有效抑制铁死亡的小分子物质。这些靶向铁死亡的小分子激活剂可直接作为化疗药物,或作为化疗增敏剂与化疗药物联合使用。但铁死亡在不同类型肿瘤及不同基因突变(如p53或RAS突变) 环境中表现复杂,在临床前期及临床研究中的可行性亟待深入研究, 值得关注的是,GPX4通路非依赖性FSP1的发现和CD8+T细胞通过释放γ干扰素诱导肿瘤细胞发生铁死亡等新机制和新靶点的发现,为肿瘤治疗和药物发现提供了全新的视角和策略。
大脑和神经组织中的铁蓄积及铁死亡已被证明与阿尔茨海默病、帕金森症、肌萎缩侧索硬化等 多种神经退行性疾病的发病存在直接联系。目前,运用铁螯合剂治疗神经退行性疾病的各种临床试验不断涌现,但针对脑卒中尚缺乏有效治疗手段。鉴于铁死亡在脑卒中后神经元死亡发挥的重要作用,有效抑制铁死亡有望为预防脑卒中引发的神经元死亡提供防治新策略。
与神经退行性疾病发病机制相似,许多心脏疾病出现共同的铁死亡特征,如铁过载、氧化应激、内质网应激和线粒体功能失常等,笔者团队前期研究提示,铁死亡抑制剂能够有效防治因心肌细胞铁过载、阿霉素诱导的心脏毒性及心脏缺血再灌注等诱发的心肌病及心力衰竭。铁死亡抑制剂、铁螯合剂、线粒体特异性抗氧化剂、血红素加氧酶1抑制剂和低铁膳食等五种不同途径均可有效防治心肌细胞的铁死亡,从而保护心脏,且这些铁死亡抑制剂在小鼠体内相对安全、可行,为靶向铁死亡防治心脏病的临床转化研究提供了乐观的前景。
着眼临床转化,需要考虑哪种疾病或肿瘤适合靶向铁死亡的治疗方法? 在临床或临床前的实验中,靶向铁死亡的药物需要有很高的组织器官特异性和较少的不良反应,纳米靶向给药系统体现了一定优势。尽管人们对铁死亡的认识日益深入,但铁死亡相关的关键科学问题仍亟待解决,如铁死亡中关键执行分子是什么? 脂质过 氧化在多大程度上与铁死亡有关? 生理过程中是 否存在铁死亡? 铁死亡在进化过程中是否保守? 路漫漫,其修远兮,随着铁死亡相关研究的不断深入与拓展,一定会为靶向铁死亡防治重大慢性疾病的临床转化提供基础。
摘自《浙 江 大 学 学 报 ( 医 学 版 )》
谱领生物针对“铁死亡”专题,推出细胞和组织中一百六十多种氧化脂肪酸代谢物(Oxylipin)检测与氧化还原代谢物(Redox metabolites)检测 ,
其中氧化脂肪酸代谢物(Oxylipin)检测包含:
亚油酸(LA)、γ-亚麻酸(GLA)、dihomo-γ亚麻酸(DGLA)、花生四烯酸(AA),α-亚麻酸(ALA),二十碳五烯酸 (EPA)和二十二碳六烯酸(DHA)及其相关的代谢途径的七十多种氧化脂肪酸代谢物。
氧化还原代谢物(Redox metabolites)检测包含:
还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、还原型烟酰胺腺嘌呤二核苷酸(NADH,还原型辅酶I)、氧化 型烟酰胺腺嘌呤二核苷酸(NAD+,氧化型辅酶I)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH,还原型辅酶II)、 氧化型烟酰胺腺嘌呤二核苷酸磷酸(NADP+,氧化型辅酶II)、半胱氨酸(Cysteine)、胱氨酸(Cystine)、谷氨酸(Glutamic acid)等。
辅酶Q10(Ubiquinones)检测包含:
氧化型辅酶Q10(Coenzyme Q10)、还原型辅酶Q10(Reduced Coenzyme Q10 )
更多服务和详细列表可联系谱领生物工作人员获取!





